Vous êtes ici
Les sucres, nouvelle arme contre les infections
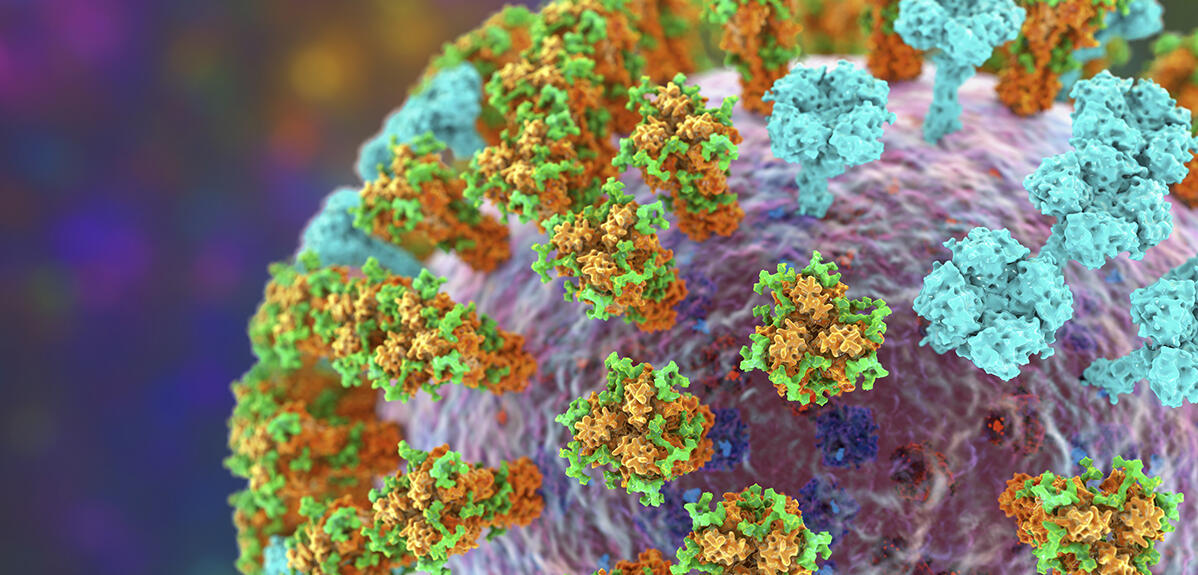
La pandémie de Covid l’a rappelé : développer de nouveaux anti-infectieux pour mieux contrer les micro-organismes pathogènes demeure un enjeu majeur. Une discipline récente, encore méconnue par le grand public, a décidé de relever ce défi en étudiant la biologie des glucides, plus connus sous le nom de « sucres ». « Baptisée glycobiologie, cette branche de la biochimie pourrait mener à de nombreuses innovations radicalement nouvelles », prévient Yann Guerardel, directeur de l’Unité de glycobiologie structurale et fonctionnelle1 (UGSF), à l’université de Lille.
Glucose du sang, amidon de la pomme de terre ou du blé, cellulose des plantes, exopolysaccharides des « biofilms » bactériens, les glucides sont présents dans tous les domaines du vivant : animaux, végétaux, microbes… Ils sont parmi les molécules biologiques les plus abondantes sur Terre. Les biochimistes les classent en deux grands groupes : les glucides simples, dits aussi « oses » ou « monosaccharides », formés d’une seule molécule (ou monomère), comme le glucose ; et les glucides complexes, constitués de plusieurs oses, tels le saccharose ou l’amidon. Appelés également glycanes, c’est spécifiquement à eux que s’intéresse la glycobiologie.
La « matière noire » de la biologie
Fait surprenant : malgré l’omniprésence des glycanes dans la nature, l’étude de leurs fonctions biologiques reste bien moins avancée que celle des acides nucléiques (qui forment l’ADN et l’ARN) et des protéines, auxquels s’intéressent respectivement la génomique et la protéomique. « Par analogie avec la situation actuelle en cosmologie, les glycanes peuvent être considérés comme la “matière noire” de l’univers biologique : un composant majeur et critique qui n’a pas encore été pleinement incorporé dans le “modèle standard” de la biologie », soulignent les chercheurs américains Ajit Varki et Stuart Kornfeld, dans un ouvrage consacré à cette discipline2.
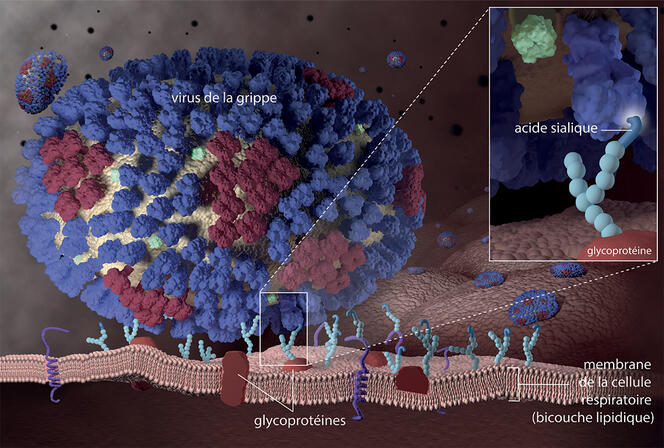
Résultat : à ce jour en France, seuls trois laboratoires sont entièrement dédiés à la glycobiologie, dont deux sous tutelle du CNRS : l’UGSF de Lille et le Centre de recherches sur les macromolécules végétales (Cermav), à Grenoble. Car en plus de jouer un rôle crucial comme sources d’énergie, les glycanes sont également essentiels pour plusieurs autres grandes fonctions biologiques : bon repliement des protéines, reconnaissance immunitaire, ou communication intercellulaire. Ils sont également impliqués dans plusieurs processus pathologiques, notamment la capacité qu’ont les micro-organismes pathogènes à adhérer aux tissus, que les glycanes peuvent empêcher ou au contraire faciliter.
L’infection par le Covid, facilitée par un sucre
Par exemple, pour pénétrer les cellules des voies respiratoires (fosses nasales, gorge, trachée, bronches, et bronchioles), le virus de la grippe se lie à un sucre présent sur ces cellules : l’acide sialique. Selon une étude japonaise menée sur des cellules cultivées en laboratoire et publiée en juin 20223, cette molécule serait également essentielle à l’« accrochage » du virus du Covid-19, le SARS-CoV-2. D’où l’idée de tenter de mieux comprendre l’implication des glucides dans l’infection par différents pathogènes. Avec un but : identifier de nouvelles cibles thérapeutiques susceptibles d’aider à développer de nouveaux traitements qui empêcheraient ou limiteraient ce type d’adhésion et donc les infections.
À Lille, Yann Guérardel et son équipe s’intéressent notamment à la bactérie Escherichia coli adhérente-invasive (AIEC). Responsable d’infections intestinales, ce germe est soupçonné d’être une des causes de la maladie de Crohn, une pathologie inflammatoire chronique de l’intestin caractérisée entre autres par des douleurs abdominales et une diarrhée importante. Jusqu’ici, de nombreuses recherches ont démontré que l’invasion de la muqueuse intestinale par cette bactérie peut être limitée par la levure Saccharomyces cerevisiae, appelée aussi « levure de bière ». Mais la nature précise des molécules derrière ce pouvoir restait méconnue.
Afin d’identifier les molécules impliquées, les chercheurs ont isolé plusieurs composants majeurs de S. cerevisiae et ont évalué leur activité anti-adhésive et anti-infectieuse contre la bactérie AIEC.
Une découverte déjà brevetée
Et bingo ! Ils ont pu identifier une fraction complexe constituée de polymères de glucose et de mannose. Celle-ci s’est avérée capable non seulement d’inhiber à 95 % l’adhésion des bactéries AIEC, mais aussi de diminuer drastiquement la colonisation de l’intestin des souris par ce pathogène. « Les glucides de cette fraction concurrencent ceux à la surface des cellules intestinales. Résultat, la bactérie s’attache sur les premiers au lieu des seconds. Ce qui empêche l’infection des cellules », éclaire Yann Guérardel. Publiée en fin 20214 et protégée par un brevet, cette découverte pourrait mener à un traitement innovant contre l’AIEC.
À Grenoble, depuis vingt ans, l’équipe d’Anne Imberty se concentre quant à elle sur un autre agent pathogène problématique : la bactérie Pseudomonas aeruginosa. Celle-ci provoque des infections pulmonaires graves chez les patients immunodéprimés ou atteints de mucoviscidose, une maladie génétique héréditaire qui entraîne une déficience respiratoire potentiellement létale. Problème, P. aeruginosa résiste aux traitements antimicrobiens actuels. D’où la nécessité de trouver de nouveaux médicaments actifs contre elle. P. aeruginosa infecte les cellules pulmonaires en se fixant – au moyen de deux protéines lectines (LecA et LecB) – à des glucides présents à leur surface appelés « mucines pulmonaires ». Grâce à la technique de cristallographie aux rayons X, qui permet de déterminer la structure en trois dimensions d’une substance donnée, le groupe a étudié la structure des complexes moléculaires formés par ces deux lectines fixées aux mucines pulmonaires5. Avec une résolution proche de l’ångström (1 Å = 0,0000001 millimètre), ils ont pu identifier chacune des liaisons qui s’établit entre ces protéines et ces sucres.
Bientôt des plateformes pour accélérer la recherche ?
Ces travaux ont conduit par la suite au développement de nouvelles molécules susceptibles d’aider à contrecarrer la résistance de P. aeruginosa aux antibiotiques. « Nos travaux ont permis à des chercheurs allemands de concevoir des composés capables de se fixer fortement à LecA et LecB. Ce faisant, ces produits empêchent la liaison de ces protéines aux mucines pulmonaires », explique Anne Imberty. Ainsi, dans des articles publiés en 2022 et début 2023, l’équipe allemande a rapporté avoir identifié deux molécules prometteuses : N‑β‑L‑Fucosylamides et le ligand sulfoné L2, capables de bloquer LecA et LecB, respectivement6. Reste maintenant à tester ces molécules chez l’humain. Ce qui devrait nécessiter encore au moins cinq années.
À l’avenir, les chercheurs en glycobiologie espèrent voir de développer des plateformes regroupant au même endroit des experts du domaine et des instruments permettant l’analyse des glucides (chromatographie, spectrométrie de masse…). Selon Yann Guérardel, il s’agit là d’« un objectif essentiel afin de rendre l’analyse des glycanes accessible à une plus large communauté scientifique et industrielle ». De quoi accélérer le développement de nouveaux anti-infectieux ? ♦
À lire sur notre site
Contrer la résistance aux antibiotiques
Ces bactéries qui vous veulent du bien
Les pouvoirs méconnus du microbiote, peuple de nos intestins
- 1. Unité CNRS/Université de Lille.
- 2. Essentials of Glycobiology, 4th edition, Ajit Varki, Richard D. Cummings, Jeffrey D. Esko et al., Cold Spring Harbor Laboratory Press, 2022.
- 3. Wakana Saso et al., PLOS Pathog, 14 juin 2022. https://doi.org/10.1371/journal.ppat.1010590
- 4. Adeline Sivignon et al., Carbohydr Polym., 1er novembre 2021. DOI: 10.1016/j.carbpol.2021.118415
- 5. Edward Mitchell et al., Nat Struct Biol., décembre 2002. DOI: 10.1038/nsb865 ; Gianluca Cioci et al., FEBS Lett., décembre 2003. DOI: 10.1016/s0014-5793(03)01249-3
- 6. Patrycja Mała et al., J Med Chem, octobre 2022. https://doi.org/10.1021/acs.jmedchem.2c01373 ; Eva Zahorska et al., Angew Chem Int Ed Engl, février 2023. https://doi.org/10.1002/anie.202215535
Mots-clés
Partager cet article
Auteur
Journaliste scientifique freelance depuis dix ans, Kheira Bettayeb est spécialiste des domaines suivants : médecine, biologie, neurosciences, zoologie, astronomie, physique et nouvelles technologies. Elle travaille notamment pour la presse magazine nationale.













Commentaires
Connectez-vous, rejoignez la communauté
du journal CNRS