Vous êtes ici
Cancer : la révolution de l'immunothérapie
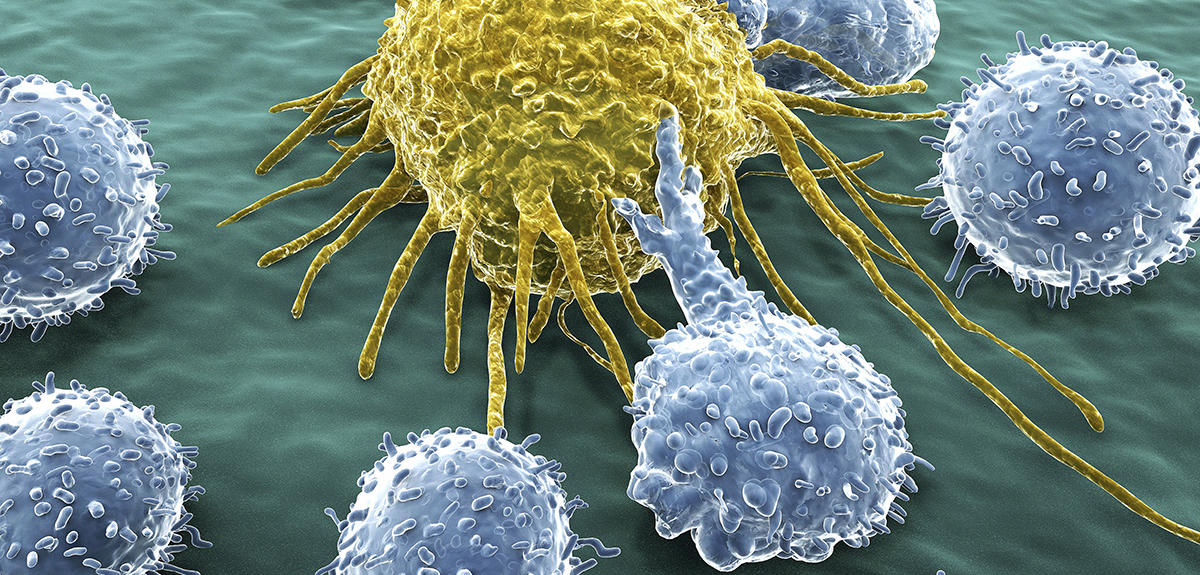
En octobre 2018, le prix Nobel de médecine est attribué à Tasuku Honjo et James P. Allison, qui, dès le milieu des années 1990, avaient commencé à mettre en évidence la possibilité d’utiliser le système immunitaire pour détruire des tumeurs. Vingt ans plus tard, l’immunothérapie est en passe de révolutionner la prise en charge de certains cancers, jusqu’alors incurables.
En temps normal, le système immunitaire, composé de cellules produites par la moelle osseuse comme les lymphocytes, est programmé pour détruire les proliférations anormales d’agents infectieux ou de cellules mutées. Or, son action sur les cellules cancéreuses est souvent trop faible, ou trop lente, pour endiguer la progression de la maladie et déclencher l’action destructrice des lymphocytes.
Face à ce constat, et depuis les années 1970, l’une des pistes thérapeutiques consiste à stimuler le système immunitaire pour diriger son action contre les cellules cancéreuses. Des injections de cytokines, molécules capables de provoquer une réaction immunitaire, ou de vaccin antituberculeux, immunostimulant, ont été tentées. Sans grand succès, car l’immunothérapie n’était pas spécifiquement dirigée contre le cancer.
Checkpoint : la cible à abattre
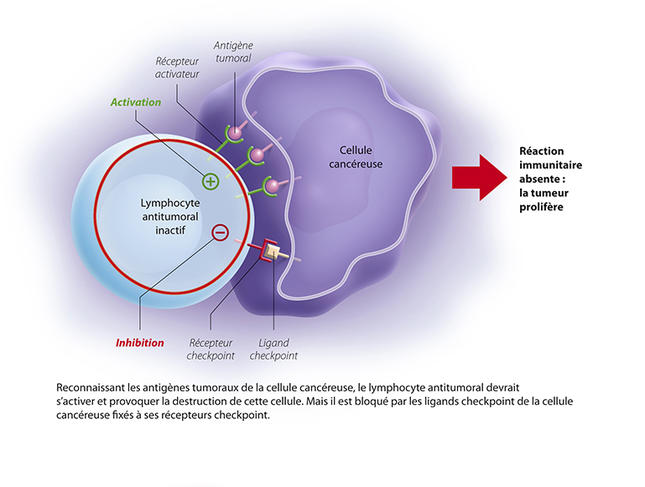
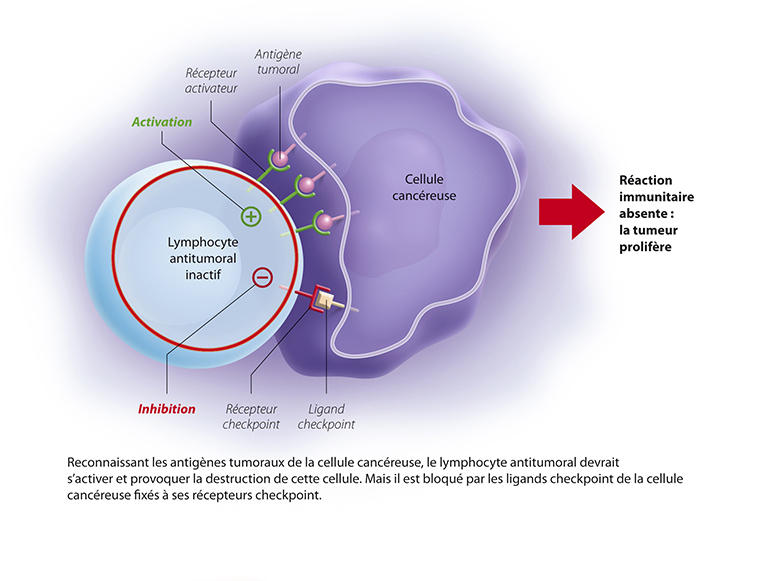
La découverte des premiers antigènes tumoraux change la donne et ouvre la voie à une approche bien mieux ciblée. Les cellules tumorales expriment, en effet, des antigènes à leur surface, qui ne sont pas retrouvés dans les cellules normales. Ces antigènes constitueraient donc autant de cibles pour un potentiel « vaccin anticancéreux ». En parallèle, et c’est l’objet des découvertes récompensées par le prix Nobel, les chercheurs ont montré que face à une cellule cancéreuse, les lymphocytes sont naturellement inhibés dans leur action par des freins moléculaires ; des freins assurés par des points de contrôle immunologique, ou « checkpoint ».
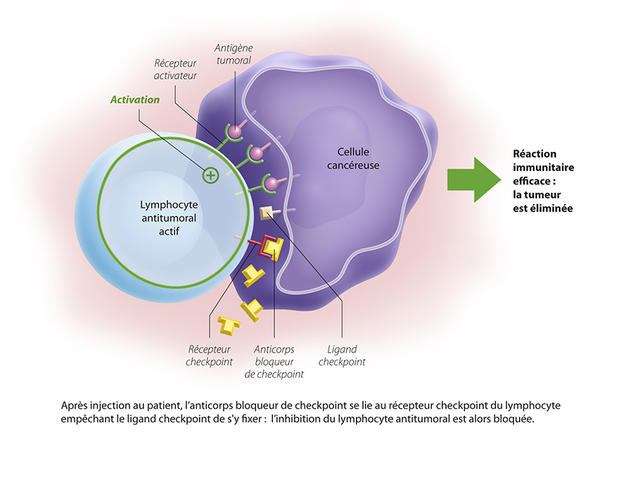
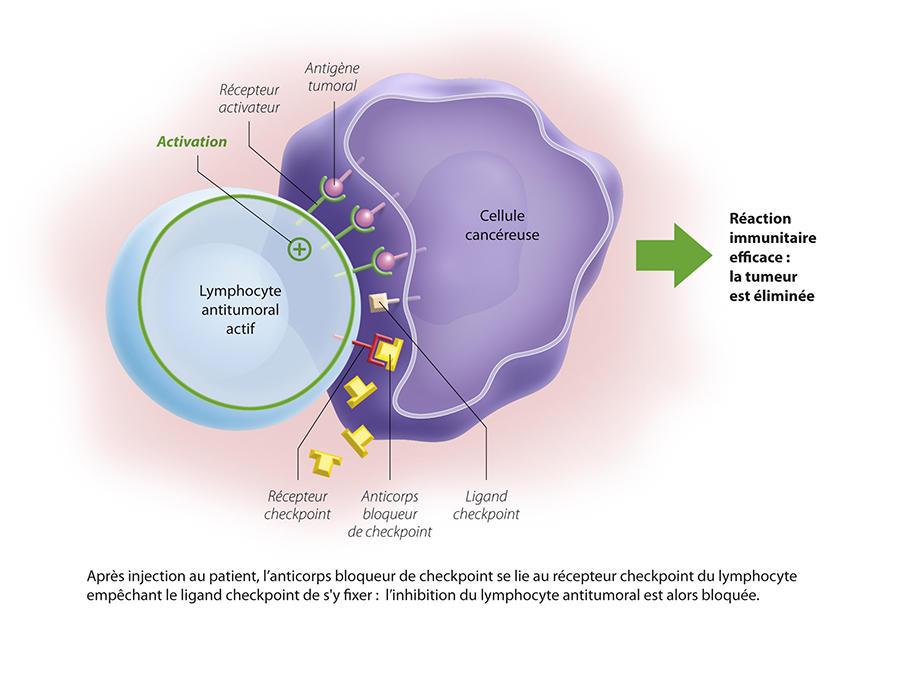
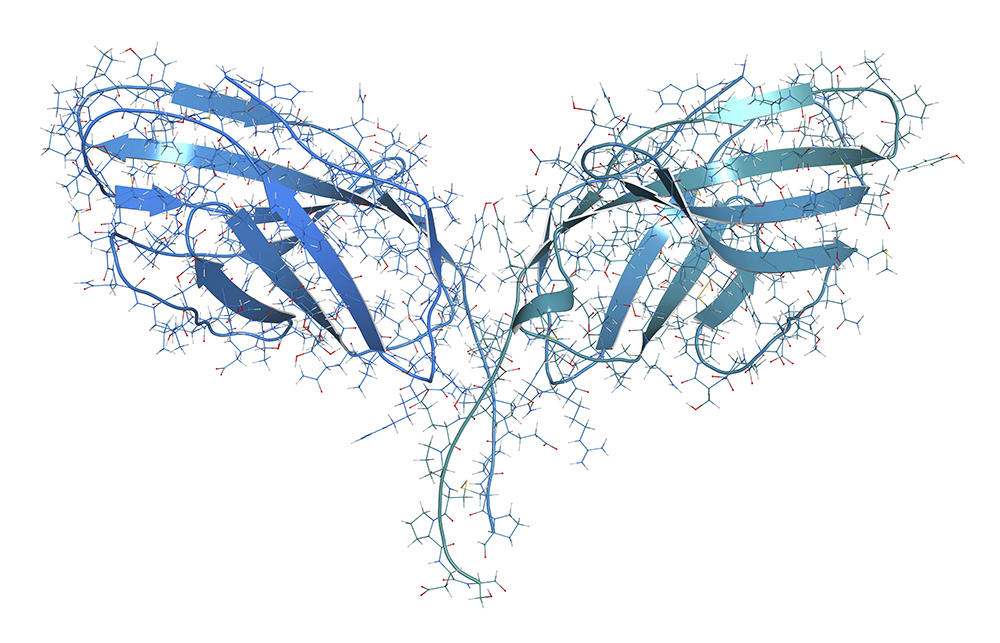
À l’origine, deux points de contrôle ont été identifiés : PD-1 et CTLA4. PD-1, exprimé par les lymphocytes va se lier à son ligand (PDL-1), exprimé lui par les cellules tumorales. Le système immunitaire est alors bloqué, et ne reconnaît pas la tumeur. L’idée est donc de déverrouiller ces freins, pour réactiver la réponse immunitaire et détruire les tumeurs. Ces découvertes ont permis de réelles avancées thérapeutiques, avec le développement d’inhibiteurs de point de contrôle : des anticorps dirigés contre ces checkpoints et capables de les bloquer.
En 2010, un anti-CTLA4 est ainsi mis sur le marché, l’ipilimumab, permettant de guérir des mélanomes avancés d’habitude très résistants. Les anti-PD1, comme le nivolumab, permettent pour leur part une réponse durable chez un tiers des patients atteints de mélanomes cutanés ou de cancers du poumon.
Le paradoxe de l’immunothérapie
« Aujourd’hui, l’immunothérapie s’est largement améliorée. Les nouvelles approches consistent à bloquer les freins. Désormais, à chaque fois qu’on identifie un nouveau checkpoint, on crée un anticorps pour le neutraliser », nous explique Jean-Jacques Fournié, directeur de recherche CNRS et chef de l’équipe « immunothérapie du lymphome » au Centre de Recherches en Cancérologie de Toulouse (CRCT)1. Avec l’immunothérapie à disposition actuellement, on estime que 1 patient sur 3 pourra y répondre positivement. La recherche s’attelle donc à mieux comprendre les différents critères de réponses aux immunothérapies.
Premier critère de bonne réponse : que la tumeur du patient exprime les points de contrôles à neutraliser par l’anticorps. « Ça paraît évident et pourtant c’était un critère controversé », car ces biomarqueurs ne sont pas toujours stables dans le temps, ils vont être exprimés de manière transitoire, quelques jours, puis disparaître. Et leur quantification n’est pas toujours standardisée », précise Jean-Jacques Fournié. Aujourd’hui, il y a consensus pour dire que l’expression de PD-1 est un critère de bonne réponse à l’immunothérapie.
Deuxième critère, qui reflète à lui seul tout le paradoxe de l’immunothérapie : plus une tumeur comporte de mutations et mieux elle va répondre aux anticorps. « En fait cela s’explique très bien d’un point de vue immunologique : plus il y a de mutations, plus il y a de néo-antigènes et donc de cibles potentielles pour le traitement », nous apprend le Pr Fournié. C’est le cas pour certains cancers du poumon, notamment chez les gros fumeurs, des cancers du côlon très mutés, ou de cancers à prédisposition héréditaire, comme le cancer du sein BRCA1. Tous au pronostic très sombre auparavant.
D’autres caractéristiques augurent une bonne réponse à l’immunothérapie, comme le fait d’avoir une tumeur localisée dans un tissu naturellement bien infiltré en lymphocytes. C’est le cas des cancers du poumon, du rein, de la peau, du côlon ou de certains lymphomes. À l’inverse, une tumeur « froide », peu enflammée, sera synonyme de moins bonne réponse à l’immunothérapie : les cancers du cerveau, de l’œil, du testicule ou de la moelle. « L’une des pistes de recherche pour améliorer l’efficacité de ces immunothérapies serait d’irradier ces tumeurs froides, pour entraîner un effet inflammatoire et donner accès au système immunitaire à des cellules qu’il ne voyait pas avant », précise Jean-Jacques Fournié.
Identifier et bloquer les freins
Les réponses à l’immunothérapie sont donc aujourd’hui très hétérogènes. « Nous nous accordons tous sur le fait que, pour l’instant, nous sommes assez naïfs de penser soigner la maladie avec seulement deux points de contrôle », confie le chercheur. Au-delà de PD-1 et CTLA4, il y aurait en réalité environ une cinquantaine de checkpoints freinant la réaction immunitaire en cas de cancer, « et plus la collection de freins est complète et combinée, mieux le cancer se développe », ajoute Jean-Jacques Fournié. À l’avenir, pour avoir une action la plus efficace possible, l’idée est de cibler plusieurs points de contrôle en même temps, à l’instar d’un antibiotique à large spectre.
C’est dans cette philosophie que Jean-Jacques Fournié, Don-Marc Franchini et leur équipe ont commencé leurs travaux en 2013. L’objectif : comprendre comment, une fois activés, les lymphocytes contrôlaient l’expression de ces checkpoints. Ils se sont rendus compte que les checkpoints étaient contrôlés par une même famille de molécules, des inhibiteurs de microtubule, déjà utilisés dans certaines chimiothérapies comme le trastuzumab.
En inhibant ces microtubules, les checkpoints ne sont plus exprimés et le système immunitaire se remet en route.
« Nous avons vu que les lymphocytes contrôlaient l’expression des points de contrôle au niveau de l’ARNFermerL’acide ribonucléique (ARN) véhicule le l'information génétique du noyau à la cellule et permet la synthèse des protéines. Et ce transfert d’ARN est associé à la production de petites molécules : des granules de stress », précise Jean-Jacques Fournié. Là où la découverte est majeure, c’est que ce mécanisme est commun à tous les checkpoints inhibiteurs, et non plus seulement à PD-1 ! « C’est une avancée majeure, car si on imagine pouvoir bloquer ces granules de stress, on bloquerait tous les checkpoints qu’elles transportent ! », s’enthousiasme Jean-Jacques Fournié. Désormais, l’équipe s’attelle à découvrir des pistes thérapeutiques inspirées de ces recherches sur les microtubules et les granules de stress.
Un anticorps pour libérer l’immunité
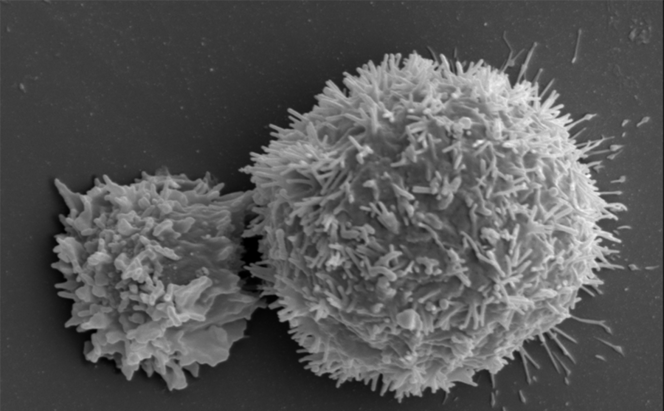
Les avancées en termes d’immunothérapie se concentrent à la fois sur la découverte de nouveaux points de contrôle, mais aussi sur le potentiel antitumoral de certaines cellules immunitaires. C’est l’objet des travaux d’Éric Vivier, professeur d’immunologie à l’Université Aix-Marseille et chercheur au centre d’immunologie de Marseille-Luminy2. Il y a dix ans, le Pr Vivier et son équipe ont découvert un tout nouveau type de cellules immunitaires, inconnues jusqu’alors : les cellules lymphoïdes innées (ILC). Un vaste sous-ensemble, dont font partie les cellules Natural Killer (NK). « Pendant des années, nous sommes passés à côté de toute une partie du système immunitaire. Les ILC ne sont ni des lymphocytes T, ni des B, c’est une toute nouvelle lignée qu’il faut désormais intégrer aux traités d’immunologie. Et bien sûr une piste supplémentaire pour l’immunothérapie », raconte le Pr Vivier.
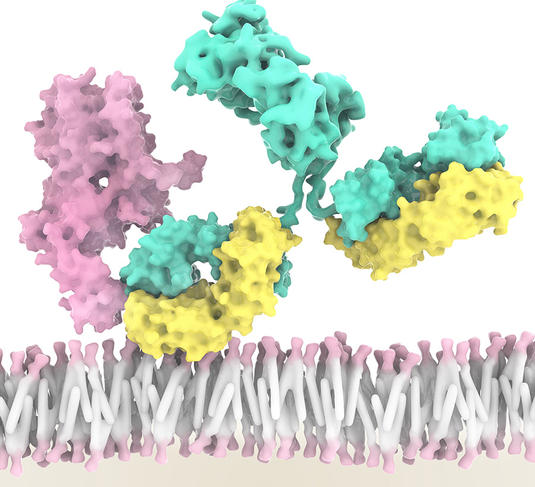
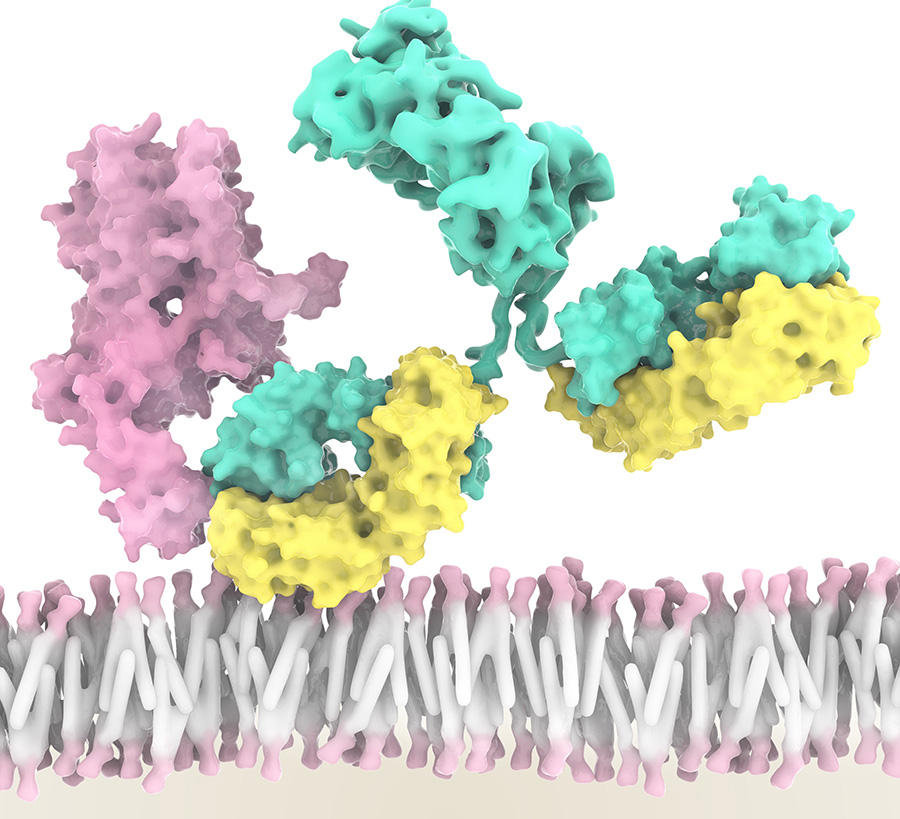
Désormais, cinq types d’ILC ont été identifiés, avec chacun des rôles dans l’inflammation et l’immunité. Les cellules NK, par exemple, peuvent reconnaître et tuer des cellules cancéreuses, tout en orientant aussi la réponse immunitaire antitumorale d’autres cellules immunitaires. « Grâce à une équipe internationale conduite par Innate-Pharma, un anticorps anti-NKG2A ou monalizumab, a été développé. Ce nouvel inhibiteur de contrôle immunitaire est capable de stimuler à la fois l’activité anti-tumorale des cellules NK mais aussi celle de sous-populations de lymphocytes T », explique Éric Vivier. Résultat : l’action des cellules NK et de certains lymphocytes T n’est plus freinée. Une action triplement combinée, car, en plus de cela, le monalizumab booste l’action du durvalumab, un anti-PDL1, mais aussi du cetuximab, un anticorps qui reconnaît les cellules tumorales.
Quels effets indésirables ?
« En associant l’un ou l’autre de ces deux anticorps à monalizumab, nous n’avons pas observé plus d’effets indésirables, ce qui est vraiment positif ! La plupart des effets secondaires sont liés à la libération de lymphocytes T, mais pas à celle des cellules NK, qui sont capables de différencier les bonnes cellules des mauvaises », précise Éric Vivier. Car l’un des enjeux cruciaux de l’immunothérapie reste d’endiguer les effets indésirables du traitement.
Parce qu’elle réactive le système immunitaire, l’immunothérapie peut entraîner des maladies auto-immunes, comme une sclérose en plaques, un diabète ou un lupus. « En analysant les données de pharmacologie à l’échelle mondiale, on se rend compte que les patients sous immunothérapie bloqueur de checkpoint ont dix fois plus souvent d’effets secondaires auto-immuns que d’autres types d’effets secondaires. C’est aussi le signe que ça fonctionne », ajoute Jean-Jacques Fournié.
« Mettre le feu par toutes les étincelles »
À l’instar de Jean-Jacques Fournié, Éric Vivier estime que l’avenir de l’immunothérapie se joue sur une stratégie à large spectre : « On vit une révolution dans les traitements du cancer. L’idée est de rajouter le maximum de piliers : de cumuler des inhibiteurs de checkpoints, de la radiothérapie, et une analyse de l’environnement tumoral pour comprendre comment rendre plus immunostimulant l’environnement de la tumeur en parallèle. » Il ajoute : « Il faut mettre le feu par toutes les étincelles. »
L’avenir de l’immunothérapie est prometteur, et suscite un espoir immense aux milliers de patients atteints de cancer. Chaque année 400 000 nouveaux cancers sont déclarés en France. Reste encore à la rendre accessible de tous, le prix d’un anticorps monoclonal atteignant souvent les 130 000 euros la cure.
« Il ne faut pas oublier que tous ces progrès sont le fruit de la recherche fondamentale. Il y a 20 ans, quand nous avons commencé à étudier les cellules immunitaires, nous n’avions pas pour vocation de soigner le cancer, désormais, nos travaux sont en prise directe avec la maladie », souligne Éric Vivier. ♦
Mots-clés
Partager cet article
Auteur
Léa Galanopoulo est journaliste scientifique indépendante.








































Commentaires
Connectez-vous, rejoignez la communauté
du journal CNRS