Vous êtes ici
Transformer les poisons naturels en médicaments

Quel peut bien être le point commun entre une bactérie qui provoque des ulcères, un escargot venimeux ou un microbe qui contamine et empoisonne les conserves ? Tous ces organismes vivants produisent de puissantes toxines, souvent mortelles pour nous. Et pourtant, en manipulant ces poisons, les chercheurs sont parvenus à détourner leur toxicité dans un but thérapeutique : qu’il s’agisse de réduire la douleur, de diminuer une inflammation ou de neutraliser des contractions involontaires.
Une toxine microbienne pour remplacer l’aspirine ?
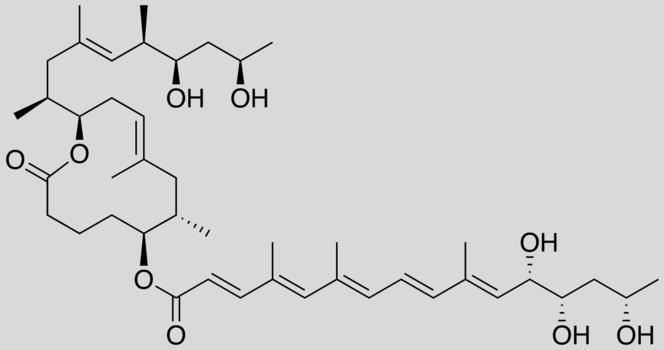
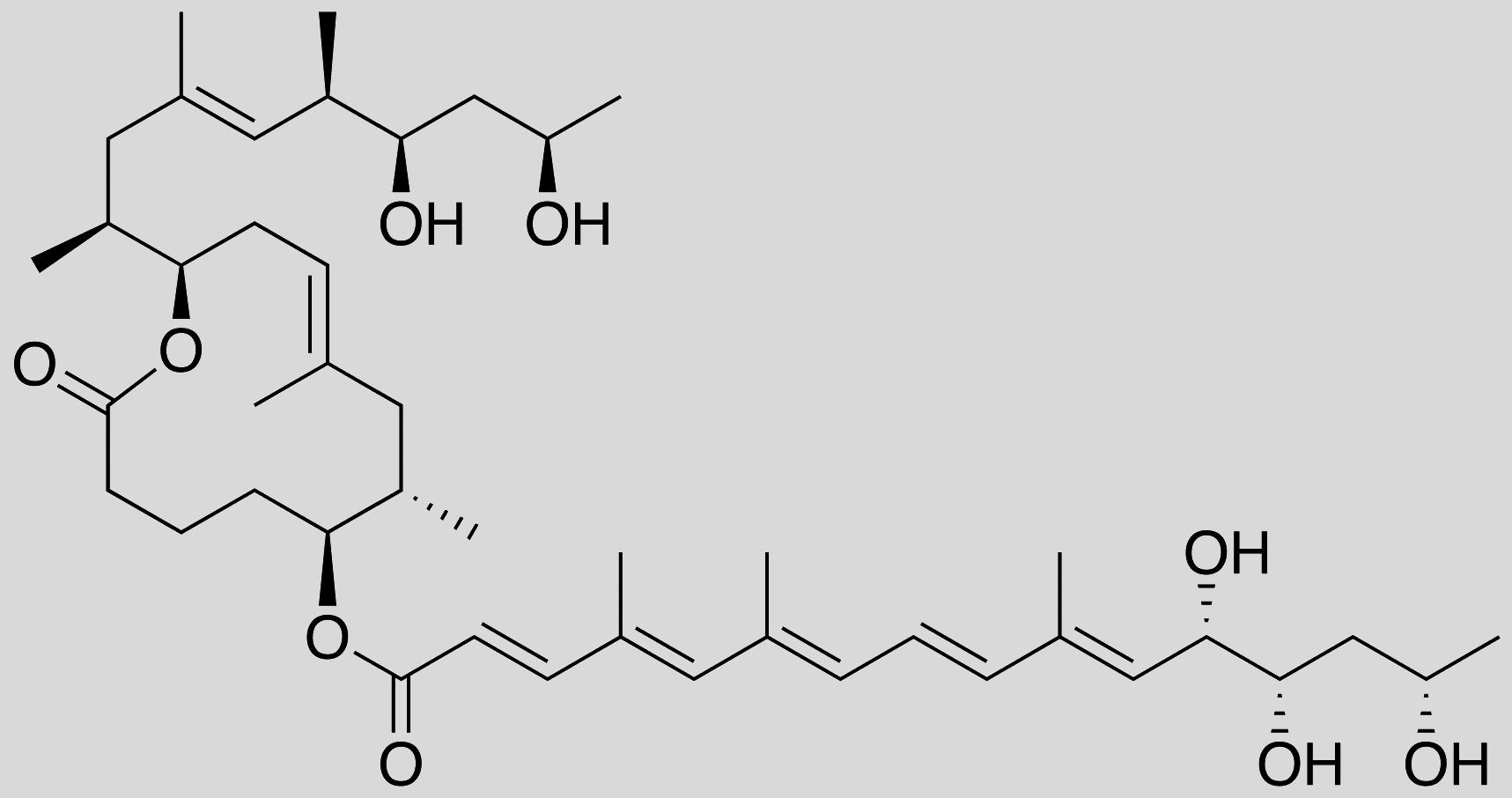
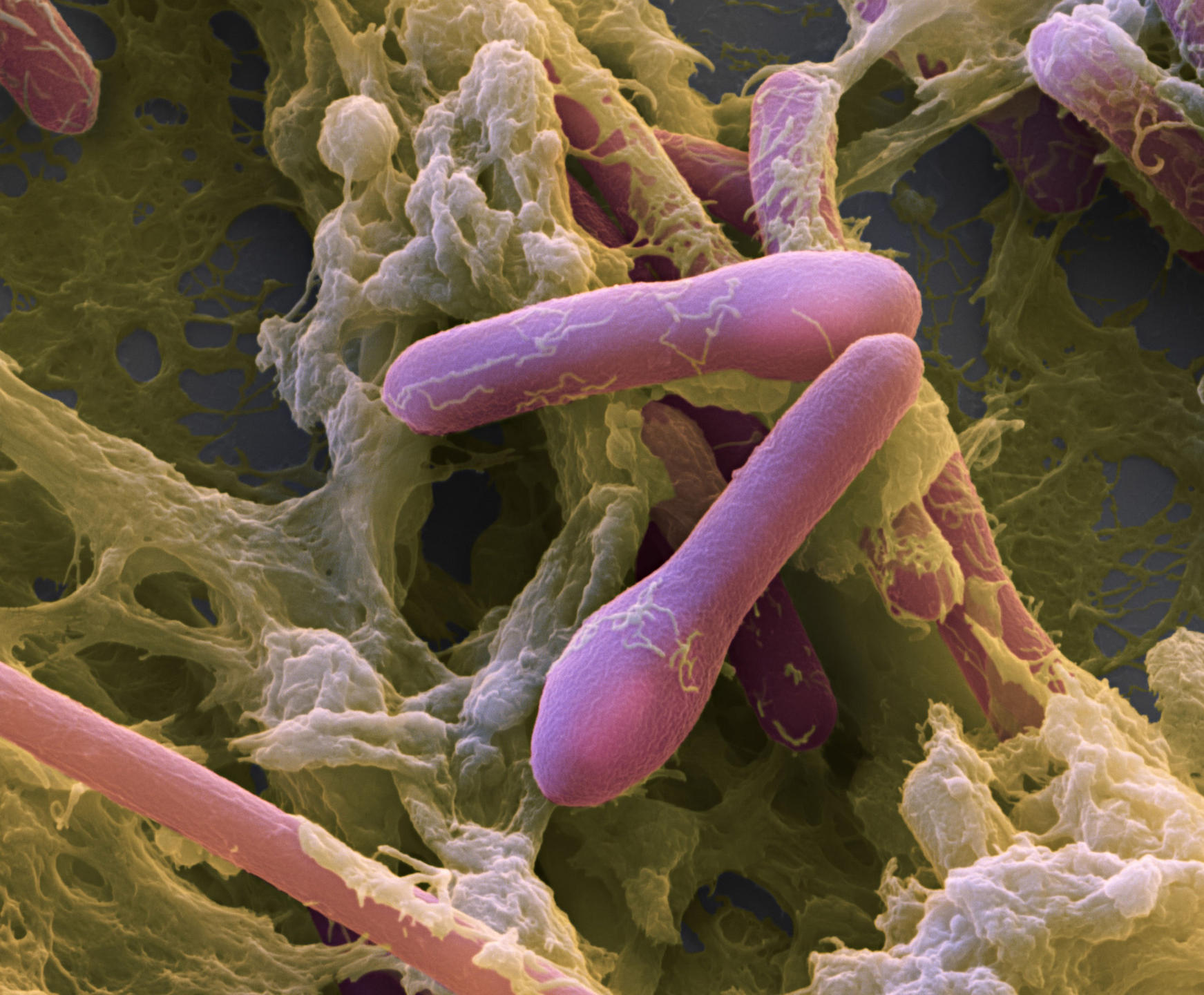
Depuis plusieurs années, les chercheurs s’intéressent de près à l’ulcère de Buruli, une pathologie tropicale qui se manifeste par la nécrose des tissus cutanés. En cause : une infection par la bactérie Mycobacterium ulcerans. Étrangement, les malades ne présentent ni douleur ni fièvre… On a d’abord découvert que l’absence de fièvre était due à l’action anti-inflammatoire d’une toxine sécrétée par la bactérie : la mycolactone. Celle-ci agit en inhibant le fonctionnement de certains globules blancs, on parle d’effet immunosuppresseur. En juin dernier, on découvrait que la mycolactone exerçait aussi un effet analgésique en se liant à certains récepteurs des neurones1. D’où l’idée d’exploiter ces propriétés pour un usage thérapeutique.
Dans cette optique, des chimistes et biologistes ont passé au crible les différents sites actifs de la mycolactone pour dénicher ceux responsables de ses effets analgésiques et anti-inflammatoires. L’équipe de Nicolas Blanchard, directeur de recherche au Laboratoire de chimie moléculaire2, à Strasbourg, a ensuite synthétisé en laboratoire une mycolactone tronquée, mais contenant les sites actifs « utiles ». Testé sur des cellules humaines par l’équipe de Caroline Demangel, directrice de recherche à l’Institut Pasteur de Paris, ce composé manifestait les mêmes effets bénéfiques que la mycolactone naturelle, avec une moindre toxicité. L’efficacité protectrice de la mycolactone tronquée a ensuite été testée sur des souris souffrant d’inflammation chronique de la peau et de douleur inflammatoire. Résultat : ces symptômes ont fortement régressé chez les rongeurs, le tout sans effet indésirable3. « Nous cherchons désormais à identifier plus finement les mécanismes mis en jeu au niveau moléculaire afin de mettre au point une mycolactone tronquée encore plus raffinée », conclut Nicolas Blanchard.
Des escargots mortels qui neutralisent la douleur
Pour dénicher de nouvelles molécules thérapeutiques, certains n’hésitent pas à explorer les fonds marins, qui regorgent d’animaux venimeux. C’est le cas de Sébastien Dutertre, chercheur à l’Institut des biomolécules Max-Mousseron4, à Montpellier. Depuis des années, il se passionne pour le cône, un escargot de mer tropical au venin mortel. Dans ce cas aussi, les scientifiques sont parvenus à transformer certaines de ses toxines, dites conotoxines, en médicaments antidouleur. Ils ont en particulier découvert que l’une d’entre elles – la ω-conotoxine MVIIA – était capable de bloquer un canal ionique situé dans la membrane des neurones. Injectée au niveau de la moelle épinière, cette toxine empêche la remontée au cerveau des messages associés à la douleur. « C’est ainsi que l’on a découvert que ce canal était impliqué dans le mécanisme de la douleur, indique Sébastien Dutertre. Plus largement, les conotoxines peuvent donc s’avérer précieuses pour identifier de nouvelles cibles thérapeutiques. » Autorisé contre les douleurs sévères en Europe et aux États-Unis, la forme synthétique de cette ω-conotoxine MVIIA demeure toutefois peu utilisée, car des effets indésirables graves peuvent survenir (cas de suicide).
n’entraînent pas
d’accoutumance
et sont faciles
à synthétiser
en laboratoire.
Qu’à cela ne tienne : les chercheurs ont identifié une autre conotoxine qui, légèrement modifiée en laboratoire, ne provoque pas d’effets secondaires. Baptisée Xen2174, elle prolonge l’action de la noradrénaline, un neurotransmetteur qui inhibe la sensation de douleur. Elle a déjà été testée avec succès sur des cancéreux pour calmer leurs douleurs chroniques. « Contrairement aux opioïdes, ces toxines de cône n’entraînent pas d’accoutumance, indique le biochimiste montpelliérain. Autre grand avantage : ce sont de petites molécules protéiques, donc faciles à synthétiser en laboratoire. On peut aussi les donner par voie orale après avoir légèrement modifié leur structure afin que les enzymes digestives ne puissent pas les dégrader. »
Et la liste des applications potentielles ne cesse de s’élargir. Les scientifiques ont notamment découvert des conotoxines capables de bloquer d’autres récepteurs moléculaires impliqués dans l’épilepsie ou l’infarctus du myocarde, avec de premiers essais encourageants sur des animaux.
Le Botox au-delà des rides
Enfin, impossible d’aborder les toxines à usage médical sans évoquer la plus célèbre d’entre elles : la neurotoxine botulique. Plus connue sous son nom commercial de Botox, elle est produite par Clostridium botulinum, une bactérie qui peut contaminer les aliments en conserve. À l’origine de paralysies mortelles, elle figure parmi les toxines les plus dangereuses. Elle agit en empêchant la libération d’acétylcholine, neurotransmetteur déclencheur de la contraction au niveau des jonctions neuro-musculaires. Aujourd’hui, la toxine botulique est prescrite à des millions de patients souffrant de pathologies liées à des contractions musculaires anormales.
Elle est ainsi utilisée depuis la fin des années 1970 pour corriger le strabisme (par injection à très faibles doses dans certains muscles moteurs des yeux). Ses indications se sont largement étendues, et pas que pour gommer les rides en paralysant les muscles situés sous la peau ! On l’utilise, en effet, pour corriger le blépharospasme (fermeture involontaire des paupières), certains torticolis, la crampe de l’écrivain… ou bien encore contre des contractions musculaires particulières des membres (spasticité) survenant après un accident vasculaire cérébral (AVC).
La toxine botulique s’avère également utile dans des indications bien plus étonnantes… On s’en sert par exemple pour traiter la transpiration excessive ou limiter la production de salive (grâce à son action inhibitrice sur les terminaisons nerveuses qui innervent les glandes produisant ces fluides corporels), contre le bruxisme (contraction excessive des mâchoires produisant notamment des grincements de dents nocturnes)… ou bien encore pour certaines formes d’incontinence dues à une vessie hyperactive.
« La possibilité de l’utiliser comme antidouleur est également envisagée depuis que l’on a observé que la douleur associée à des torticolis dits dystoniques pouvait céder indépendamment de la contraction musculaire, explique Bernard Poulain, directeur de recherche CNRS à l’Institut des neurosciences cellulaires et intégratives de Strasbourg. Depuis, des travaux ont montré que la neurotoxine botulique bloquait aussi la libération des neurotransmetteurs impliqués dans le transfert des informations nociceptives à l’origine de la douleur. Quant à son effet analgésique par action dans le système nerveux central, cela reste à démontrer. » Douleur, contractions, inflammation, maladies neurodégénératives, cancer, maladies sanguines… En attendant, la liste des pathologies empoisonnées par les toxines ne cesse de s’allonger !
Sur le même sujet : « Le mamba noir s'attaque à la douleur »
- 1. « Mycobacterial Toxin Induces Analgesia in Buruli Ulcer by Targeting the Angiotensin Pathways », Estelle Marion et al., Cell, 19 juin 2014, vol. 157 (7) : 1565-1576.
- 2. Unité CNRS/Univ. de Strasbourg.
- 3. « Shaping Mycolactone for Therapeutic Use Against Inflammatory Disorders », Laure Guenin-Macé et al., Science Translational Medicine, 27 mai 2015, vol. 7 (289).
- 4. Unité CNRS/Univ. de Montpellier/ENSCM Chimie Montpellier.
Mots-clés
Partager cet article
Auteur
Journaliste scientifique, Jean-Philippe Braly est spécialisés dans les thématiques santé/sciences du vivant, environnement/écologie/nature et nouvelles technologies. Il collabore notamment avec CNRS Le journal, le magazine La Recherche, les agences de presse Canopy et Look at Sciences. Producteur de documentaires pour l’émission de France Culture « Sur les Docks », il anime...
















Commentaires
Connectez-vous, rejoignez la communauté
du journal CNRS