Vous êtes ici
L’ère de la cancérologie numérique

Comment mieux détecter certaines tumeurs ? Peut-on prédire leur évolution ou leur réponse à un traitement ? Quel est le mécanisme de prolifération des cellules cancéreuses ? Voici quelques-unes des questions sur lesquelles planche l’équipe de cancérologie numérique Michel Laudet. Officiellement créée en avril 2022, cette structure est le fruit d’une collaboration de plusieurs années entre l’Institut de recherche en informatique de Toulouse1 (Irit) et le Centre de recherche en cancérologie de Toulouse2 (CRCT).
« L’abondance des données biomédicales et médicales est devenue telle qu’elle ne peut plus être traitée par le cerveau humain. Seule l’intelligence artificielle (IA), associée à l’expertise des médecins, est aujourd’hui capable de trier, classer, et surtout d’exploiter cette masse d’informations », souligne Jean-Marc Alliot, directeur scientifique pour les données et l’intelligence artificielle au CHU de Toulouse.
Un constat partagé par le professeur membre de l'Académie de médecine Pierre Brousset, directeur du Labex Toucan (Toulouse Cancer) et chef du département d’anatomie et cytologie pathologiques à l’IUCT-Oncopole3, pour lequel il ne fait aucun doute : « l’oncologie est aujourd’hui sous dépendance absolue des informaticiens et non l’inverse ! Que ce soit la biostatistique, la bio-informatique à travers le séquençage haut débit des génomes tumoraux ou l’intelligence artificielle, ce sont autant d’outils numériques qui enrichissent en permanence nos connaissances sur le cancer et renouvellent les stratégies thérapeutiques. »
Des outils pour aider au diagnostic
Hébergée au 4e étage de l’imposant bâtiment du CRCT, la dizaine de chercheurs de l’Irit sont spécialisés dans la conception d’algorithmes bio-inspirés (reproduisant le vivant), les logiciels d’apprentissage automatique (machine learning ) et le traitement et l’analyse des signaux (images et sons). « La plupart avait déjà mené des projets dans le domaine de la recherche médicale, précise Sylvain Cussat-Blanc, chercheur à l’Irit et membre de l’Aniti4. L’avantage ici, c’est de pouvoir travailler en constante interface avec les chercheurs, ce qui a pour effet de dynamiser et d’accélérer les projets. » Depuis la création de l’équipe de cancérologie numérique Michel Laudet, près d’une quinzaine de projets ont été lancés ou sont en cours. Tous s’effectuent en binôme avec un informaticien et un médecin ou chercheur. « Comme dans toute recherche pluridisciplinaire, le principal défi consiste à trouver un langage commun pour bien définir la question à laquelle le chercheur souhaite que nous répondions, et pour bien expliciter les possibilités et les contraintes de l’intelligence artificielle », détaille Jean-Marc Alliot.
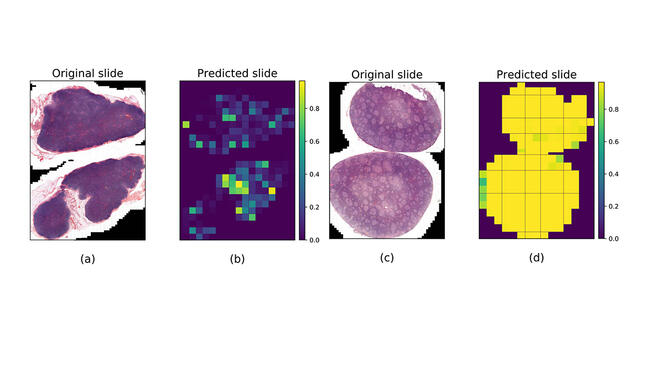

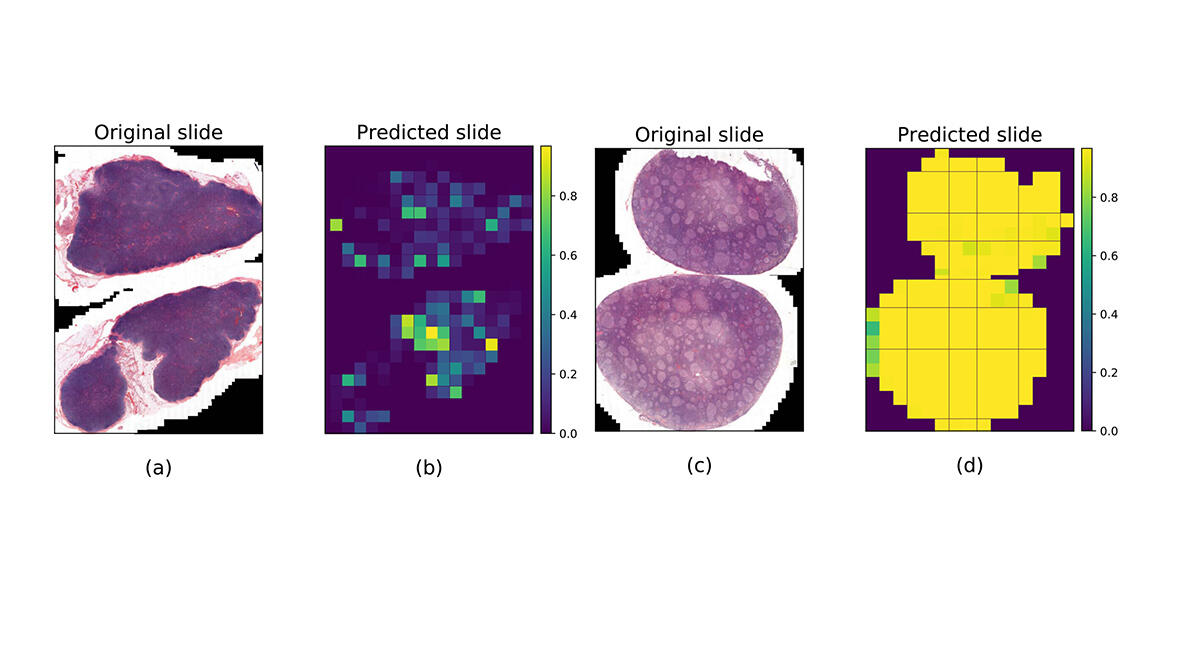
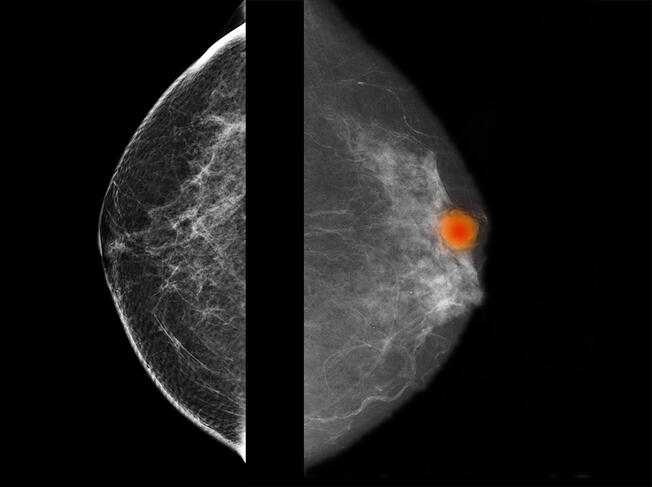
Les algorithmes d’apprentissage sont les plus sollicités par les médecins-chercheurs et en particulier par les anatomo-pathologistes, pour lesquels la question de l’aide au diagnostic est centrale. « La prise en charge du cancer repose en grande partie sur l’examen microscopique des lames de tissus biologiques réalisé par l’anatomo-pathologiste, rappelle Pierre Brousset, spécialiste des lymphomes. Or, certaines lésions sont complexes, difficiles à caractériser, ce qui peut induire des erreurs graves de diagnostic. »
En 2020, le chercheur a contribué à la création d’un algorithme d’apprentissage5 pour différencier le lymphome folliculaire – un cancer des lymphocytes dans les ganglions – de l’hyperplasie folliculaire – une maladie bénigne –, ces deux lésions présentant souvent des caractéristiques similaires. Pour entraîner l’algorithme à les reconnaître, 378 images de lames entières provenant du CHU de Toulouse ont été utilisées, qui présentaient pour une moitié des tissus de ganglion lymphatique infiltrés par le lymphome folliculaire, et pour l’autre moitié par l’hyperplasie folliculaire. Résultat, dans 99 % des cas, le logiciel a effectué un diagnostic précis des lésions, « ce qui surpasse les performances d’un pathologiste aidé de son seul microscope », admet Pierre Brousset.
L’algorithme entraîné a ensuite été testé sur des images des CHU de Dijon et de Montpellier mais avec un taux de réussite de 65 %. « Cet écart ne nous surprend pas, note Jean-Marc Alliot. Tant que les données médicales des hôpitaux ne seront pas produites pour l’usage spécifique des algorithmes, avec des méthodes et des formats uniformisés, il y aura des biais qui modifieront les performances de l’IA ». L’application pourrait toutefois entrer en phase expérimentale au CHU de Toulouse dans les prochains mois.
Guider la décision thérapeutique
Plusieurs projets similaires d’aide au diagnostic sont actuellement en cours. Ils portent sur l’identification et la reconnaissance des lésions buccales potentiellement cancéreuses mais aussi certaines tumeurs du sein difficiles à caractériser. Aux côtés de Camille Franchet, anatomo-pathologiste à l’IUCT-Oncopole, l’équipe Michel Laudet participe au projet Apprentissage profond renforcé par l’immunohistochimie pour la requalification d’images de cancers du sein (APRIORICS)6 visant à utiliser l’intelligence artificielle pour décrire les tumeurs le plus précisément possible, à partir de très nombreux paramètres. L’objectif étant de concevoir des modèles prédictifs afin d’optimiser le diagnostic.
En 2021, un algorithme a été conçu avec l’hématologue Sarah Bertoli pour prédire la survie des patients atteints par la leucémie myéloïde aigüe. Dans ce cancer qui se développe dans la moelle osseuse, la question était de pronostiquer la survie des patients à un temps donné pour les deux traitements les plus utilisés.
Pour entraîner le logiciel, les données cliniques, génomiques et thérapeutiques de 5 000 patients suivis durant 20 ans aux CHU de Bordeaux et de Toulouse ont été homogénéisées et traitées. Les résultats7 ont montré que dans près de 70 % des cas, le pronostic de survie s’avérait exact. Dans 90 % des cas, l’algorithme d’apprentissage était capable, à partir des données médicales au moment du diagnostic, de choisir le même traitement que celui préconisé par un hématologue expert.
Une nouvelle étude vient d’être lancée avec le professeur Marlène Pasquet, hemato-immunologiste au CHU de Toulouse et chercheuse au CRCT, pour cette fois prédire l’évolution d’une forme rare de la leucémie myéloïde aigüe chez les jeunes patients et définir la meilleure option thérapeutique en fonction de leur profil moléculaire. « Ces algorithmes n’ont pas vocation à se substituer au médecin, rappelle le professeur Pierre Brousset, mais à terme, d’être une aide à la prise en charge personnalisée des patients. »
Décrire les processus biologiques et trouver de nouvelles pistes thérapeutiques
« L’intelligence artificielle ne se résume pas aux algorithmes d’apprentissage, insiste l’informaticien David Simoncini, chercheur à l’Irit, spécialisé dans la modélisation de nouvelles protéines thérapeutiques . Il existe toute une branche de l’IA basée sur la logique. Ce sont les modèles de simulation et d’optimisation utilisés lorsqu’un chercheur souhaite clarifier des phénomènes biologiques complexes. Ils sont particulièrement puissants pour mettre en lumière certaines interactions, tester ou suggérer des hypothèses. »
Ces modèles sont capables de simuler la prolifération des cellules cancéreuses et de prédire leur évolution ou leur réponse à un anticancéreux. En reproduisant les mécanismes d’attaque des lymphocytes T cytotoxiques8 (utilisés en immunothérapie) à l’encontre des cellules cancéreuses, Sylvain Cussat-Blanc a ainsi pu modéliser l’action du traitement à différents dosages afin d’optimiser son efficacité sur les cellules tumorales. Il a aussi mis en évidence9 l’effet du Nocodazole (un anticancéreux) sur les cellules cancéreuses du colon et révélé certains effets sur le cycle de vie cellulaire, jusque-là inconnus.
Sylvain Cussat-Blanc collabore depuis plusieurs années avec Pierre Cordelier, directeur adjoint du CRCT et spécialiste des virus oncolytiques dans le cancer du pancréas (l’un des plus meurtriers). « Non seulement, les virus oncolytiques ciblent les cellules cancéreuses tout en épargnant les cellules saines, détaille le chercheur, mais ils ont aussi la capacité de stimuler le système immunitaire, ce qui pourrait laisser présager qu’en combinant la virothérapie avec l’immunothérapie, l’effet oncologique final serait plus important ».
Après avoir conçu un algorithme reproduisant l’infection des cellules cancéreuses par un virus oncolytique, les deux chercheurs ont intégré dans le modèle les lymphocytes T cytotoxiques et, depuis, multiplient les simulations en se basant sur les données biologiques. Cet échange interdisciplinaire constant contribue à l’émergence de nouvelles hypothèses de travail et permet ainsi une meilleure compréhension de certains mécanismes biologiques. « C’est un moyen de redéfinir notre façon de traiter le patient, explique-t-il. La modélisation du vivant constitue à cet égard une nouvelle source de découvertes fondamentales en oncologie et d’optimisation des médicaments et des biothérapies du futur ».
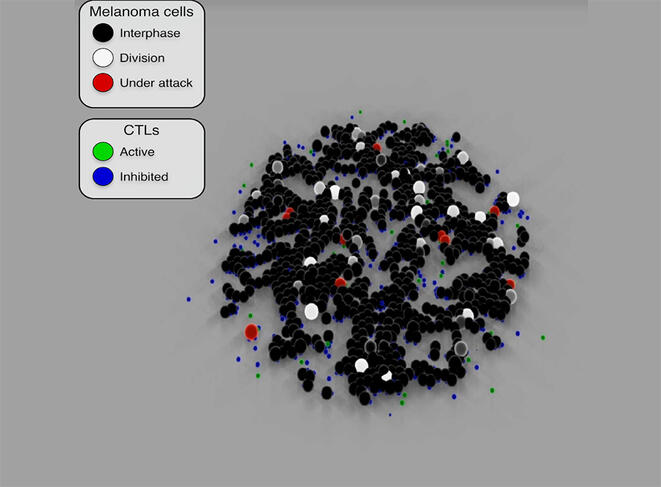

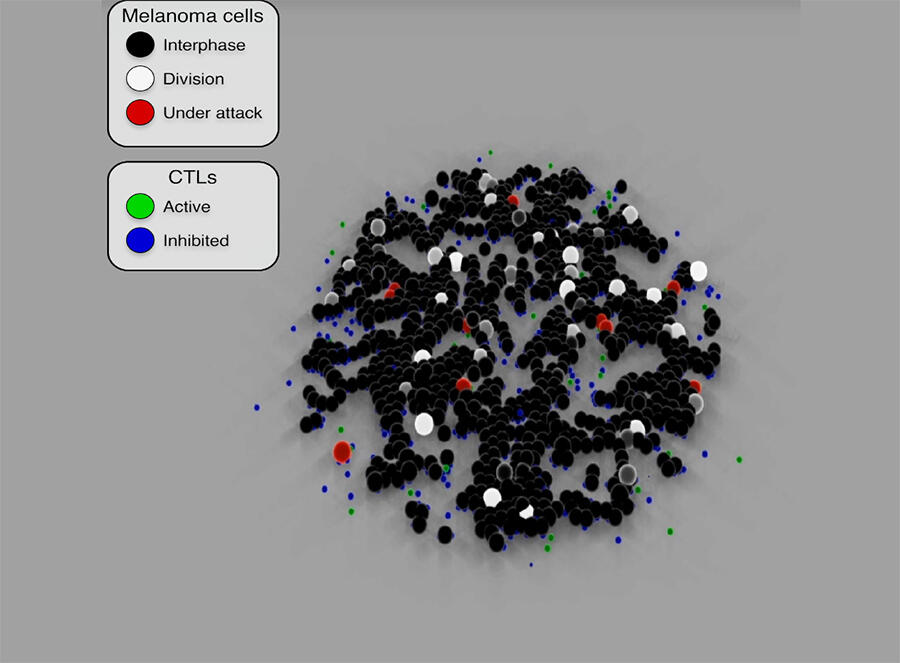
Des algorithmes plus explicables
Contrairement aux algorithmes d’apprentissage dont il est souvent impossible de comprendre les détails précis de leurs décisions, et donc d’où provient le résultat, les modèles de simulation présentent un atout considérable : ils sont fiables et explicables. Tous les résultats obtenus lors des différentes étapes de la modélisation font en effet l’objet d’une vérification in vitro en laboratoire pour valider les hypothèses. « Notre objectif, c’est de développer des algorithmes les plus transparents possibles, explicables et traçables de façon à fournir au praticien des outils d’IA dont les résultats permettent d’expliquer au patient ce qui l’a conduit à établir ce diagnostic ou cette option thérapeutique », souligne Sylvain Cussat-Blanc.
Pour contrer l’effet « boîte noire » des algorithmes d’apprentissage, lui et son collègue Simon Simoncini ont conçu une nouvelle méthode de machine learning capable de fonctionner avec peu de données et transparente sur sa façon de raisonner. Le logiciel est actuellement en cours d’expérimentation au sein de l’équipe et le brevet d’ores et déjà déposé. ♦
- 1. Unité CNRS/Institut national polytechnique de Toulouse/Université Toulouse Paul Sabatier.
- 2. Unité CNRS/Inserm/Université Toulouse Paul Sabatier.
- 3. L’Institut universitaire du cancer de Toulouse Oncopole regroupe les services d’oncologie du CHU-Toulouse et l’Institut Claudius Regaud.
- 4. Artificial and Natural Intelligence Toulouse Institute.
- 5. « Accurate diagnosis of lymphoma on whole-slide histopathology images using deep learning », Charlotte Syrykh et al, npj/Digital Medicine, 1er mai 2020. https://doi.org/10.1038/s41746-020-0272-0
- 6. https://www.health-data-hub.fr/projets/apprentissage-profond-renforce-pa...
- 7. https://www.sciencedirect.com/science/article/pii/S0006497121053179
- 8. « Sequential adjustment of cytotoxic T lymphocyte densities improves efficacy in controlling tumor growth » (« Modélisation des interactions entre lymphocytes T et cellules tumorales et optimisation des injections »), Roxana Khazen et al., Scientific Reports, 23 août 2019. https://doi.org/10.1038/s41598-019-48711-2
- 9. « A checkpoint-oriented cell cycle simulation model »(« Modélisation du cycle cellulaire et de l’impact d’une molécule thérapeutique sur son déroulement »), David Bernard et al., Cell Cycle, 4 avril 2019. https://doi.org/10.1080/15384101.2019.1591125
Mots-clés
Partager cet article
Auteur
Journaliste et auteur, Carina Louart est spécialisée dans les domaines du développement durable, des questions sociales et des sciences de la vie. Elle est notamment l’auteur de La Franc-maçonnerie au féminin, paru chez Belfond, et de trois ouvrages parus chez Actes Sud Junior : Filles et garçons, la parité à petits pas ; La Planète en partage à petits pas ; C’...

















Commentaires
Dominique Rodriguez
José Rodriguez le 18 Novembre 2023 à 18h26Connectez-vous, rejoignez la communauté
du journal CNRS