Vous êtes ici
Un nouvel anticorps dédié à la lutte contre le cancer
Chirurgie, chimiothérapie, radiothérapie, mais aussi, depuis quelques décennies, thérapies ciblées et immunothérapie… l’arsenal thérapeutique contre le cancer n’a jamais été aussi important. Problème, à l’instar des bactéries qui peuvent devenir insensibles aux antibiotiques, les cellules cancéreuses peuvent elles aussi développer une « résistance » aux traitements anti-cancer, et leur échapper. Vaincre ce phénomène est donc crucial pour améliorer la survie à long terme des patients.
Or, voilà qu’une molécule développée en France, à Lyon, pourrait aider à relever ce défi. Et ce, de façon « universelle », pour tous les types de traitements anti-cancer chimiques existants. « Fruit de près de deux décennies de recherche, notre molécule s’est avérée très prometteuses lors de deux études, publiées en août 20231,2 », se réjouit Patrick Mehlen, directeur du Centre de recherche en cancérologie de Lyon3. « Ce potentiel nouveau traitement constitue une nouvelle approche thérapeutique originale. Tout n’est pas encore gagné. Mais l’espoir est grand de le voir venir enrichir l’arsenal thérapeutique et améliorer la lutte contre différents cancers aujourd’hui très difficiles à traiter », commente Éric Solary, chercheur à l’Institut Gustave Roussy4 et membre du conseil d’administration de la Fondation ARC pour la recherche sur le cancer.
Anticorps thérapeutique
De quoi s’agit-il concrètement ? D’un anticorps monoclonal (produit en laboratoire), baptisé NP137. « Comme les anticorps fabriqués par notre système immunitaire lors d’une infection, cet anticorps est capable de bloquer spécifiquement un composé. Lequel consiste ici non pas en une molécule de virus ou de bactérie, mais en une protéine présente dans la plupart des cancers : la nétrine-1 », détaille Patrick Mehlen. L’aventure scientifique qui a mené à ce composé a commencé il y a plus de vingt ans. Le biologiste lyonnais et son groupe travaillent alors sur un processus qui fait défaut dans les cellules cancéreuses : la mort cellulaire programmée, ou apoptose, qui permet aux cellules infectées ou anormales de s’autodétruire. L’équipe s’intéresse notamment à un récepteur cellulaire capable d’induire l’apoptose : une protéine appelée DCC5, identifiée initialement lors de travaux portant sur les tumeurs du côlon. Or, l’action de ce récepteur peut être bloquée par une protéine… la fameuse nétrine-1, cible privilégiée de l’anticorps NP137 ! D’où l’intérêt des chercheurs pour cette molécule.
Lors de premiers travaux chez la souris parus en 20046, l’équipe avait fait une découverte significative : alors que la nétrine-1 était connue surtout pour guider le développement des neurones chez l’embryon, ils découvrent que chez l’adulte, elle peut aussi favoriser la survenue du cancer colorectal. Au fil des années, les chercheurs lyonnais apportent la preuve de l’implication de la nétrine-1 dans plusieurs autres types de cancers dits « solides » (du sein, du poumon, de la peau…) et « liquides » (touchant les éléments du sang, comme le lymphome). S’impose alors à eux l’idée de bloquer la nétrine-1 pour tuer les cellules cancéreuses. Leur concept prend forme en 2014, avec le développement de l’anticorps NP137 grâce à des fonds levés par Netris-Pharma, une start-up médicale créée en 2008. Enfin, après des études précliniques chez la souris puis l’obtention des autorisations nécessaires, le groupe lance en 2017 une première étude visant à tester cet anticorps chez l’humain. Ce sont les résultats de cet essai de phase 1Fermer Essai mené sur des volontaires ayant des cancers très avancés, qui vise à évaluer la toxicité, en fonction du temps, d’une nouvelle molécule thérapeutique., impliquant 14 patientes atteintes d’un cancer avancé de l’endomètre (paroi interne de l’utérus), qui ont été publiés dans une des deux études parues en août dernier7.
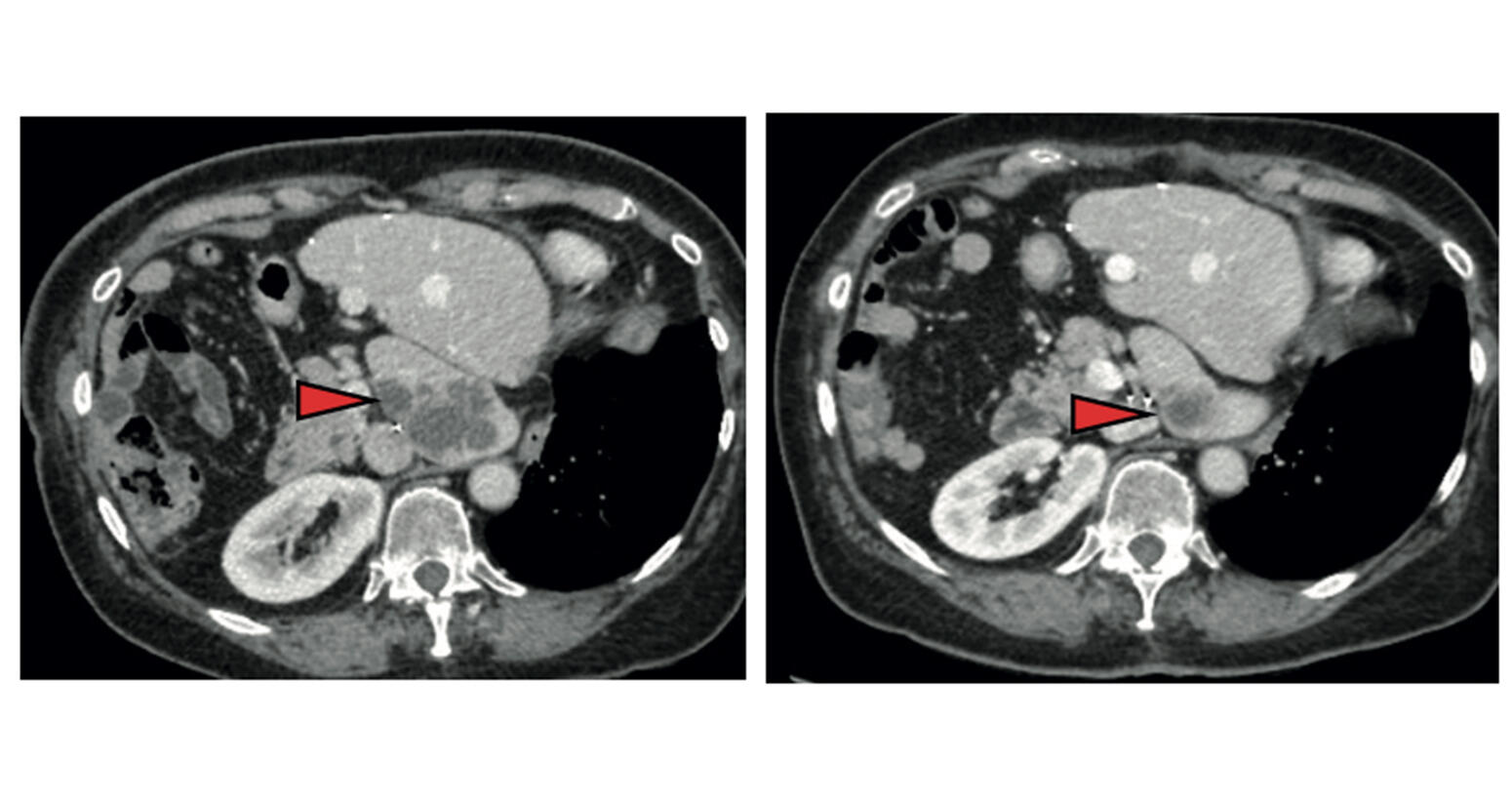
Résultat : non seulement NP137 s’est avéré non toxique mais il a de plus stoppé la progression de la maladie chez plus de la moitié des patientes (8 sur 14). Mieux, chez l’une d’elles, les chercheurs ont noté après six semaines de traitement une réduction de plus de 50 % des métastases, ces tumeurs formées dans d’autres organes à partir de la tumeur primitive apparue au niveau de l’endomètre. Forts de ces résultats, les chercheurs ont alors administré, à des souris atteintes d’un cancer de l’endomètre, NP137 associé à une chimiothérapie (carboplatine-paclitaxel). Cette combinaison s’est révélée plus efficace que la chimiothérapie seule, et permettrait non seulement de réduire les tumeurs mais aussi potentiellement d’atténuer leur résistance aux traitements.
Des résultats prometteurs
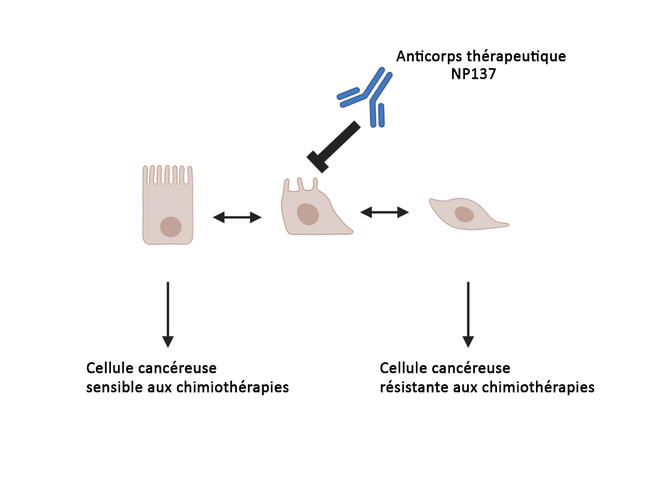
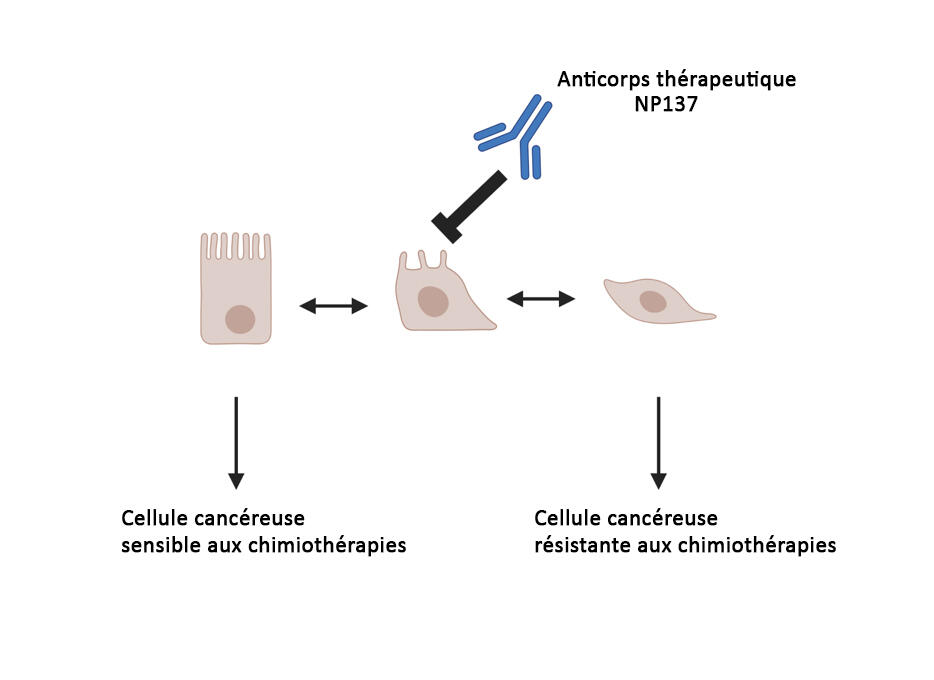
Et il n’y a pas que la chimiothérapie ! Selon de plus récents travaux chez la souris8, publiés en octobre 2023, NP137 atténuerait aussi la résistance aux traitements d’immunothérapie. Via quel mécanisme ? Lors de la seconde étude publiée en août 20239, codirigée par Cédric Blanpain, chercheur à l'Université libre de Bruxelles et Patrick Mehlen, les scientifiques ont réalisé plusieurs expériences de biologie cellulaire et de génétique chez des souris atteintes d’un cancer cutané épidermoïde (un cancer de la peau sévère) et sur des cellules tumorales humaines. Au final, il est ressorti que le blocage de la nétrine-1 par l’anticorps NP137 permet de contrecarrer un des principaux mécanismes de résistance des tumeurs : la « transition épithélio-mésenchymateuse ».
Cette transition permet aux cellules cancéreuses proliférantes de changer de statut et d’acquérir la propriété de « casser » le socle sur lequel elles reposent, la matrice extracellulaire. Désormais, elles ont accès au reste du corps via le système circulatoire et peuvent par conséquent métastaser et ainsi échapper aux traitements. « Ces dernières – appelées cellules mésenchymateuses –, ont tendance à moins se multiplier, ce qui les rend moins sensibles à la chimiothérapie. De plus, elles produisent des molécules qui les cachent, comme des molécules qui inhibent le système immunitaire ; ce qui peut les rendre résistantes à l’immunothérapie », explique Patrick Mehlen. « Cibler cette transition épithélio-mésenchymateuse est un objectif majeur poursuivi depuis plusieurs années par beaucoup de chercheurs. L’équipe de Patrick Mehlen est la première à l’avoir atteint grâce à NP137 », relève Éric Solary.
Reste toutefois à s’assurer rigoureusement que cet anticorps permet bien d’inhiber le phénomène de résistance chez l’humain. « C’est justement là tout l’enjeu de quatre nouveaux essais cliniques de phase 2Fermer Ces essais se déroulent sur des personnes malades et ont pour objectif de déterminer la tolérance, comme pour la phase 1, mais surtout l’efficacité de la molécule testée. cette fois, qui sont en cours et qui concernent plusieurs types de cancers », révèle Patrick Mehlen. Nommé « GyNET », un premier essai porte sur près de 240 femmes atteintes d’un cancer de l’endomètre ou du col de l’utérus avancé, suivies dans 15 centres médicaux français. Elles reçoivent soit une chimiothérapie standard seule, soit une chimiothérapie et/ou une immunothérapie, combinées à NP137. Les trois autres essais cliniques devraient inclure, au total, environ 200 personnes. L’un, dit « panier », porte sur des patients résistants à l’immunothérapie, quel que soit leur cancer ; le second porte sur le cancer du pancréas ; et le dernier sur le cancer du foie. Le but : vérifier que cet anticorps améliore l’efficacité des traitements auxquels il est ajouté.
Les résultats de ces différentes études devraient être disponibles dans les mois à venir. « S’ils sont probants, nous pourrons alors passer aux essais de phase 3Fermer Essais permettant d’évaluer l’intérêt thérapeutique d’une molécule sur un grand nombre de patients., pour confirmer l’efficacité de cet anticorps sur plus de patients (jusqu’à 500) et demander une autorisation de mise sur le marché », termine Patrick Mehlen. Selon le biologiste, si tout se passe bien, les autorités de santé pourraient donner leur feu vert pour une utilisation large de NP137 à l’horizon 2026. De quoi améliorer significativement la lutte contre le cancer ? ♦
À lire sur notre site :
Cancer : la révolution de l'immunothérapie
- 1. P. A. Cassier et al., Nature, 2 août 2023, doi : 10.1038/s41586-023-06367-z
- 2. J. Legrand et al., Nature, 2 août 2023, doi : 10.1038/s41586-023-06372-2
- 3. Unité CNRS/Inserm/Université Claude Bernard Lyon 1/Centre anticancéreux Léon Bérard.
- 4. Au sein de l'unité Analyse moléculaire, modélisation et imagerie de la maladie cancéreuse (CNRS/Inserm/Institut Gustave Roussy/Université Paris-Saclay).
- 5. Initiales de « deleted in colorectal cancer » pour « supprimé dans le cancer colorectal ».
- 6. L. Mazelin et al. Nature. 2 septembre 2004. doi: 10.1038/nature02788.
- 7. P. A. Cassier et al., op cit, 2023.
- 8. B. Ducarouge et al. Cell Death Differ. Octobre 2023. doi: 10.1038/s41418-023-01209-x.
- 9. J. Legrand et al., 2023, op. cit.
Mots-clés
Partager cet article
Auteur
Journaliste scientifique freelance depuis dix ans, Kheira Bettayeb est spécialiste des domaines suivants : médecine, biologie, neurosciences, zoologie, astronomie, physique et nouvelles technologies. Elle travaille notamment pour la presse magazine nationale.


















Commentaires
L'approche de cibler la
CBDtechfr Cbd s... le 16 Novembre 2023 à 09h20Connectez-vous, rejoignez la communauté
du journal CNRS