A la une
En janvier dernier, deux articles publiés dans la revue Cell créaient une onde de choc dans le monde des neurosciences en montrant qu’un gène particulièrement important dans les processus d’apprentissage et de mémorisation est capable de former des capsides* virales pour transmettre une information aux cellules voisines ! Serait-ce une nouvelle forme de communication entre neurones ? Les chercheurs Jason Shepherd (J. S.), neuroscientifique et spécialiste du gène Arc de l’université de l’Utah, et Cédric Feschotte (C. F.), généticien et spécialiste des transposons* de l’université de Cornell, nous racontent leur découverte.
Le gène neuronal Arc (Activity-regulated cytoskeleton-asscoiated protein) appartient à la famille des gènes immédiats précoces, c’est-à-dire des gènes qui sont induits très rapidement en réponse à l’activation des neurones. Ce gène est impliqué dans diverses formes de plasticité synaptique*, et il est crucial pour le maintien des souvenirs à long terme. Cependant, les fonctions moléculaires de ce gène dans les neurones restent largement méconnues, tout comme ses origines évolutives. Comment en êtes-vous arrivé à travailler sur le gène Arc et à explorer ce genre de mécanismes ?
J. S. : Je travaille sur ce gène depuis le tout début de ma carrière. Lorsque j’ai commencé mon propre laboratoire, je voulais en savoir plus sur la biochimie de la protéine Arc. Lorsque nous avons voulu purifier la protéine, nous avons fait une observation particulièrement inattendue… En effet, nous avons trouvé de façon surprenante que les protéines Arc s’oligomérisaient – assemblage de plusieurs protéines – et formaient ce qui ressemblait à des capsides virales ! Nous avons ensuite utilisé des techniques de bio-informatique pour étudier la séquence de ce gène et en savoir plus sur ses origines et son histoire évolutive. C’est ce qui a lancé tout le reste de l’étude.
Qu’avez-vous découvert sur les origines et l’histoire évolutive du gène Arc ?
C. F. : Il avait été précédemment établi que Arc dérivait d’un gène (de type Gag) qui ressemble à celui codé par les rétrovirus et que l’on trouve aussi dans un groupe d’éléments génétiques mobiles endogènes appelés les rétrotransposons, qui sont d’ailleurs très courants dans les génomes de vertébrés. En effet, la moitié du génome humain est composé de rétrotransposons ! Nos analyses phylogénétiques* ont permis d’établir que le gène Arc que nous étudions chez les rongeurs est né il y a environ 350 millions d’années chez l’ancêtre commun des vertébrés terrestres (tétrapodes). Ainsi, nous avons pu identifier un homologue direct de Arc chez les amphibiens, les reptiles, les oiseaux, et les mammifères, mais pas chez les poissons. En revanche, c’est chez ces derniers (poisson zèbre, carpe, cœlacanthe) que nous avons identifié les rétrotransposons les plus directement apparentés à Arc et qui appartiennent au groupe « Gypsy ». Il apparaît donc que le gène Arc descend d’une lignée de rétrotransposons de type Gypsy qui vagabondaient chez l’ancêtre commun des tétrapodes.
Par ailleurs, nos analyses évolutives ont permis d’établir que le gène de la drosophile (dArc), qui est apparenté à Arc et est caractérisé dans l’article comme ayant des propriétés très similaires à celui des modèles murins (souris, rats), a une origine complètement indépendante. En effet, le gène dArc est confiné aux mouches et dérive d’une autre lignée de rétrotransposons qui est courante chez les insectes mais distincte de celle qui a donné naissance au gène Arc chez l’ancêtre des tétrapodes. Ces résultats indiquent que les similarités fonctionnelles, biochimiques et cellulaires de Arc et dArc sont le résultat d’une forme de convergence évolutive qui reflète leur provenance de rétrotransposons apparentés (voire l’article publié conjointement avec le travail des Drs. Shepherd et Feschotte).
Suite à ces découvertes sur les origines et l’histoire évolutives de ce gène, les auteurs de l’étude ont mis en place un ensemble d’expériences pour tester si les protéines Arc présentaient le même fonctionnement dans des cellules et analyser ce mécanisme. Ils ont dans un premier temps montré que plusieurs protéines Arc étaient bien capables de s’auto-assembler de façon spontanée pour former des structures qui ressemblent à des capsides, et qu’elles stockaient leur propre matériel génétique, dans ce cas précis sous forme d’ARN messager*. Dans le cas des virus, les capsides virales peuvent stocker soit de l’ARN soit de l’ADN. Par la suite, les auteurs de l’étude ont vérifié que ce mécanisme était également présent dans des neurones de l’hippocampe de souris en culture. Ils ont alors ajouté ces capsides dans le milieu, qui ont alors « infecté » les neurones avec leur matériel génétique. De plus, ils ont montré que les protéines Arc s’auto-assemblaient dans ces cellules en culture (Figure 1), qu’elles encapsulaient l’ARN messager et que les capsides produites étaient ensuite libérées en dehors des cellules via des vésicules extracellulaires (Figure 1). Une fois libérées, ces capsides protègent le matériel génétique, sont capables « d’infecter » d’autres neurones et de transférer de façon abondante l’ARN message dans les neurones cibles (Figure 1).
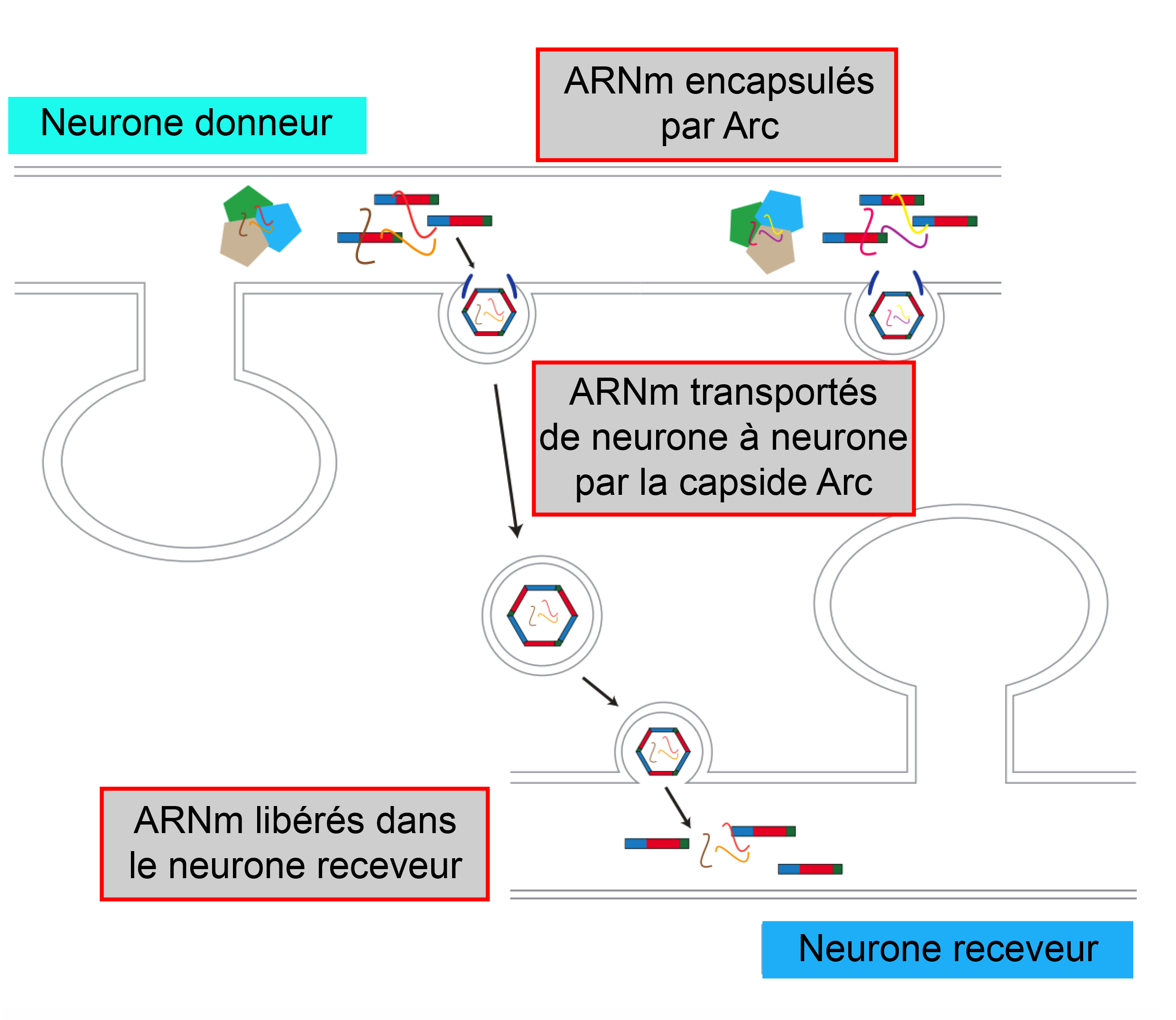
Figure 1 : 1/ Dans le neurone donneur, les protéines Arc s’auto-assemblent et encapsulent l’ARN messager (ARNm) de Arc. 2. Les capsides produites sont libérées dans le milieu extracellulaire via des vésicules. 3. Les capsides « infectent » le neurone receveur.
Sur quelle distance ces vésicules extracellulaires contenant les capsides Arc ou les capsides sont-elles capables de voyager ? Pourraient-elles potentiellement atteindre d’autres régions cérébrales, ou même des organes autres que le cerveau ?
J. S. : C’est une bonne question dont nous n’avons pas encore la réponse. Nous faisons des expériences sur ce sujet… Mais pour le moment nous ne savons pas encore jusqu’où elles sont capables de se déplacer.
Pour le moment, vous n’avez réalisé ces expériences que dans des cellules en culture ; est-ce que ce mécanisme a pu être mis en évidence dans le cerveau des mammifères ?
J. S. : Nous faisons face à un important défi pour montrer ce mécanisme dans le cerveau mais nous essayons actuellement de l’étudier.
À votre avis, quel pourrait être le rôle de cette encapsulation dans le cerveau des mammifères ?
J. S. : C’est une excellente question ! Nous sommes actuellement en train de réaliser des expériences pour déterminer plus précisément les molécules transportées par ces capsides et quelles fonctions ce genre de mécanisme pourrait jouer notamment dans la plasticité synaptique et la mémoire.
Comment expliquez-vous qu’un tel mécanisme soit resté sous le radar pendant toutes ces années ?
J. S. : Je pense que cela souligne le peu que nous savons sur le cerveau, la biologie en général et ces mécanismes ! En 2006, un article avait prédit que le gène Arc possédait une homologie avec la séquence Gag virale dont Cédric vous a parlé, mais aucun neuroscientifique n’a fait attention à cet article à l’époque ! C’est pourquoi j’aime interagir et apprendre dans d’autres domaines que les neurosciences, on ne sait jamais quand une information deviendra utile !
Pensez-vous qu’il existe d’autres gènes comme Arc, qui pourrait utiliser le même type de mécanisme ?
C. F. : C’est très probable ! Les rétrotransposons qui ont donné naissance à Arc et dArc sont extrêmement abondants dans les génomes eucaryotes*. Il est connu qu’ils sont à l’origine de plusieurs gènes « domestiques » dont les fonctions cellulaires restent mystérieuses et il y a plus de cinquante gènes de ce type dans le génome humain ! Comme ces gènes restent très similaires en structure et séquences à ceux de leurs rétrotransposons ancestraux, il y a fort à parier que certains ont préservé la capacité d’encapsuler et de transporter leur propre ARN messager entre les cellules. Il est également probable que ce type de mécanisme puisse servir des fonctions très variées dans des organes autres que le cerveau. Par exemple, il est connu que certains gènes apparentés à des capsides de rétrotransposons sont exprimés exclusivement dans le placenta. Il est possible que ces gènes participent à un réseau de communication cellulaire à l’interface entre la mère et le fœtus.
Selon vous, cette découverte va-t-elle changer notre façon de comprendre comment le cerveau fonctionne ?
J. S. : Je pense que cela ouvre certainement plus de questions sur la façon dont les cellules communiquent et se transmettent les signaux les unes aux autres dans le système nerveux. Beaucoup de recherches en perspective ! Nous avons besoin de comprendre le rôle fonctionnel de cette nouvelle voie de communication dans les fonctions cérébrales, notamment la plasticité synaptique et la mémoire. Cela signifie qu’il va falloir explorer les molécules transportées par cette voie, la spécificité de leur destination, mais aussi ce qui se passe dans les cellules cibles.
C. F. : Arc représente seulement la partie visible d’un iceberg de séquences dérivées d’éléments génétiques mobiles et parasitiques (virus, transposons). Ces éléments sont à la fois très variés, dotés de capacités biochimiques sophistiquées, et sont extrêmement répandus dans les génomes. Nos découvertes et celles de nombreux laboratoires révèlent que ces séquences d’origines vagabondes représentent un réservoir important pour la formation d’innovations génétiques et cellulaires au cours de l’évolution. Arc s’ajoute à une liste qui s’allonge rapidement d’exemples de systèmes moléculaires nés des cendres de ces éléments parasitiques dispersées dans les génomes et qui sont souvent ignorés des études traditionnelles mais qui constituent un puissant outil évolutif.
Pour finir, est-ce-que vous pensez que ce genre de mécanisme pourrait être utilisé à des fins de recherches mais aussi cliniques ? Notamment, de nouvelles façons de penser et de développer des outils génétiques efficaces pour remplacer les vecteurs viraux actuellement utilisés dans certains outils en recherche ou thérapeutiques ?
J. S. : Oui, en effet. Nous étudions actuellement la possibilité d’utiliser les capsides Arc pour le génie génétique afin d’administrer de l’ARN ou de l’ADN de manière ciblée dans les cellules via la thérapie génique. Nous étudions également le rôle du gène Arc dans le système immunitaire, avec l’idée que peut-être Arc serait un meilleur outil que les vecteurs viraux car il ne déclencherait pas de réponses immunitaires, contrairement aux vecteurs viraux.
Alors que nous considérons les infections virales comme une source de nuisance, ces épisodes d’infection fournissent également de nouveaux substrats d’évolution pour créer de nouveaux gènes qui deviennent finalement bénéfiques pour l’organisme. L’étude présentée ici reflète combien la recherche fondamentale inspirée par la curiosité peut mener à d’importantes découvertes. En effet, s’il est largement admis que les neurones communiquent via des signaux chimiques ou électriques, le transfert direct de matériel génétique de neurone à neurone via des vésicules extracellulaires n’avait jusqu’alors jamais été décrit. Ainsi, une rencontre fortuite entre un virus et nos lointains ancêtres il y a environ 350 millions d’années a peut-être ouvert la voie à certains processus cognitifs et pourrait également inspirer les approches de thérapie génique de demain.
*Un peu de vocabulaire
ARN messager = acide ribonucléique messager = copie transitoire d’un gène après transcription avant d’être traduit en protéine dans la cellule
Capside = Structure constituée de protéines qui entoure le génome d’un virus
Eucaryote = Organisme vivant dont l’information génétique est protégée par un noyau constitué par une membrane nucléaire.
Phylogénétique = système de classification des êtres vivants
Synapse = zone de contact fonctionnelle entre deux neurones ou entre un neurone et une autre cellule (cellules gliales, cellules musculaires, récepteurs sensoriels, …)
Transposon = séquence d’ADN capables de se déplacer de manière autonome dans un génome
Références
1. The Neuronal Gene Arc Encodes a Repurposed Retrotransposon Gag Protein that Mediates Intercellular RNA Transfer. Pastuzyn ED, Day CE, Kearns RB, Kyrke-Smith M, Taibi AV, McCormick J, Yoder N, Belnap DM, Erlendsson S, Morado DR, Briggs JAG, Feschotte C, Shepherd JD. Cell. 2018 Jan 11;172(1-2):275-288.e18. doi: 10.1016/j.cell.2017.12.024.
2. Retrovirus-like Gag Protein Arc1 Binds RNA and Traffics across Synaptic Boutons. Ashley J, Cordy B, Lucia D, Fradkin LG, Budnik V, Thomson T. Cell. 2018 Jan 11;172(1-2):262-274.e11. doi: 10.1016/j.cell.2017.12.022.
--------------------------------------------------------------------------------------------------------------------------------
Jason Shepherd
http://shepherdlab.org/teammembers/jason-shepherd/
Laboratoire : www.shepherdlab.org
Twitter : @Jasonsynaptic
Cédric Feschotte
Cédric Feschotte est né à Toulouse et a obtenu un doctorat de l’université Pierre et Marie Curie à Paris en 2001. Il est actuellement professeur dans le département de Biologie Moléculaire et Génétique à l’université de Cornell dans l’état de New York. Depuis plus de 20 ans, il étudie les éléments transposables et virus endogènes et en particulier comment ces éléments influencent la fonction de génomes et l’évolution des organismes.
Laboratoire : http://blogs.cornell.edu/feschottelab/
Twitter : @CedricFeschotte
--------------------------------------------------------------------------------------------------------------------------------
Alexandra Gros est docteure en neurosciences (Institut des neurosciences Paris-Saclay). Au cours de sa thèse, elle s’est intéressée au rôle de la neurogenèse adulte hippocampique dans les processus d’apprentissage et de mémoire, notamment épisodique. Alexandra est actuellement chercheuse post-doctorante à l’université d’Édimbourg où elle étudie comment la mise en mémoire et la persistance de souvenirs d’événements de la vie courante peuvent être affectées par un apprentissage ultérieur. Pour cela, elle cherche à élucider les mécanismes moléculaires et cellulaires sous-tendant ces processus, notamment via des mécanismes de « tagging » des neurones et synapses en utilisant l’expression des gènes immédiats précoces.
Antoine Besnard est docteur en neurosciences (2011, UPMC). Durant son doctorat, il a étudié les mécanismes moléculaires qui contrôlent les adaptations du cerveau en réponse à la cocaïne sous la direction de la Dr Jocelyne Caboche. En 2012, Antoine rejoint l’équipe du Dr Amar Sahay située au Massachusetts General Hospital (Boston). Il utilise des techniques optogénétiques afin de visualiser et contrôler l’activité des cellules du cerveau. Son travail vise à décoder les circuits neuronaux qui contrôlent la peur et l’anxiété. Ces études sont importantes puisque de nombreuses maladies psychiatriques perturbent ces circuits ainsi que ces comportements. Restaurer l’activité de ces circuits pourrait donc un jour permettre de soigner ou même prévenir ces maladies du cerveau. Twitter : @AntoineBesnard3




Commentaires
Connectez-vous, rejoignez la communauté
du journal CNRS