Vous êtes ici
La ruée vers l’or nanométrique
Ce texte fait l’objet d’une publication commune avec The Conversation, partenaire du Forum du CNRS 2017, auquel participent Hazar Guesmi et Olivier Pluchery.
Depuis toujours l’or n’a cessé de fasciner l’homme : sa couleur jaune dorée, sa rareté ou encore son caractère inaltérable lui ont donné à nos yeux une valeur inégalée. Mais depuis quelques années, il est aussi sous la loupe des scientifiques qui explorent ses propriétés nanométriques.
En effet, les petits grains d’or sous forme de nanoparticules, de taille allant typiquement de 1 à 100 nanomètres (nm), possèdent des propriétés qui diffèrent considérablement du comportement de l’or massif. Ainsi, l’or nanométrique change de couleur et de comportement et acquiert des propriétés physiques et chimiques inattendues.
Les apparences colorées de l’or ont intéressé les scientifiques, et avant eux les alchimistes du Moyen Âge. Cependant, c’est à Michael Faraday que l’on doit d’avoir établi en 1857 le lien entre la taille des particules et la couleur de l’or colloïdal. Par la suite, l’or a été quelque peu négligé par les scientifiques avant de refaire parler de lui dans les années 1980, quand on lui découvrit des propriétés catalytiques.
Aujourd’hui, l’engouement pour les nanoparticules d’or est favorisé par les progrès faits dans notre compréhension de ces matériaux, de leur synthèse et propriétés physiques ainsi que de leur potentiel applicatif en catalyse, en détection chimique et biologique, dans le traitement du cancer, en tant que marqueurs pour la microscopie électronique à transmission (TEM) ou à effet tunnel (STM), sans oublier divers domaines de la photonique et de l’électronique.
Nano-optique
L’interaction très particulière de la lumière avec les nanoparticules d’or leur confère une apparence colorée bien différente de la couleur d’un lingot d’or pur. Les nanoparticules d’or sphériques de 20 nm de diamètre sont rouge rubis car elles piègent les longueurs d’onde vertes (on ne perçoit donc que la couleur complémentaire, le rouge). Si, au lieu de nanosphères, on fabrique des nano-bâtonnets de taille semblable, leur couleur prend une teinte bleutée ou violette. C’est une conséquence d’un effet de confinement de l’onde électromagnétique dans ces nano-objets métalliques.

Ce domaine de la nano-optique est passionnant car il permet de « sculpter » les ondes lumineuses sur des distances bien plus petites que la longueur d’onde de la lumière, ce qui semblait une gageure il y a quelques années. Les chercheurs ont appris à jouer avec les formes de nano-objets pour contrôler ainsi les ondes électromagnétiques à des échelles sub-longueur d’onde : ce sont des sphères, des triangles, des nano-étoiles, des nano-oursins et chacune de ces formes a une couleur différente. Tout ce domaine nouveau s’appelle la plasmonique et il trouve des ramifications non seulement en optique, mais aussi en réactivité chimique et surtout dans le domaine médical.
Nano-réservoirs d’or à électrons
Les nanoparticules intéressent aussi le domaine de l’électronique, qui d’ailleurs est le premier débouché industriel pour les producteurs d’or. Les technologies de la microélectronique ont développé l’art de contrôler les courants électriques pour transmettre des signaux binaires et donc de l’information. C’est le cœur du fonctionnement de nos ordinateurs et de nos smartphones. La clé des évolutions futures réside dans notre capacité à miniaturiser toutes ces fonctions de traitement de l’information.
Dans cette course technologique, les nanoparticules apparaissent comme des conducteurs ultimes pour ce qui est de la taille. Et plus passionnant encore, les nano-courants électriques qu’ils véhiculent adoptent de nouveaux comportements. Ce sont des comportements quantiques où les particules sont des « nano-réservoirs » à électrons, si petits qu’ils permettent de contrôler un courant électrique, électron par électron. Ainsi, il peut être envisagé une électronique avec les plus faibles courants imaginables, comme une miniaturisation ultime.

Catalyseurs de réactions chimiques
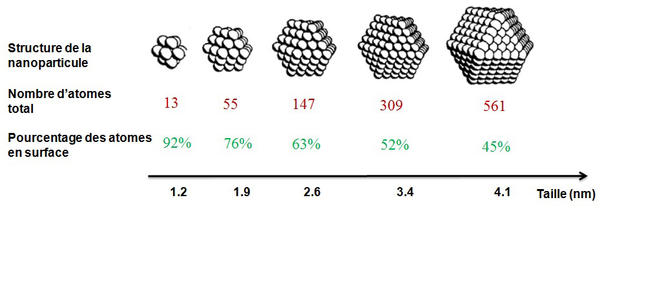
D’une manière générale, la réactivité des nanoparticules vis-à-vis de réactions chimiques provient de leur très grande surface utile par rapport à leur volume. En effet, la conséquence la plus significative de la diminution de la taille des particules est l’augmentation du rapport surface-volume. Cette hausse de la fraction des atomes en surface (voir la figure ci-dessous) s’accompagne par des changements structuraux significatifs qui affectent directement la réactivité.
Par exemple, la distance entre les atomes d’or dans la nanoparticule peut diminuer jusqu’à 15 % par rapport à l’or massif. De même, plus les nanoparticules sont petites, plus on y trouve des atomes « sous-coordinés » instables : Ce sont des atomes situés sur les sommets et les bords des nanoparticules et qui ont la particularité d’avoir perdu plusieurs atomes proches voisins (le nombre de proches voisins dans le volume étant de douze atomes).
Les études théoriques indiquent que les atomes sous-coordinés sont le siège de la réactivité chimique accrue et sont donc les sites préférentiels pour l’adsorption des molécules réactives telles que le monoxyde de carbone (CO), le dihydrogène (H2), le dioxygène (O2), etc. À la différence d’autres métaux, la nature noble de l’or empêche une forte adhésion de ces molécules sur la surface et leur permet d’interagir et de se transformer. C’est le caractère modéré de cette liaison qui est à la base de la réactivité surprenante des catalyseurs à base d’or dans l’oxydation de CO (CO + ½O2 = CO2) à basse température, entre 25 et 70 °C. Une réaction qu’aucun autre métal n’est capable de catalyser à de telles températures. Une raison de plus de penser que la ruée vers l’or est encore loin d’être terminée dans les laboratoires.
Les points de vue, les opinions et les analyses publiés dans cette rubrique n’engagent que leur auteur. Ils ne sauraient constituer une quelconque position du CNRS.
Retrouvez le programme complet du Forum du CNRS qui aura lieu les 25 et 26 novembre 2017 et inscrivez-vous sur le site de l'événement.
Partager cet article
Commentaires
Connectez-vous, rejoignez la communauté
du journal CNRS