Vous êtes ici
Santé : les promesses de l’élasticité
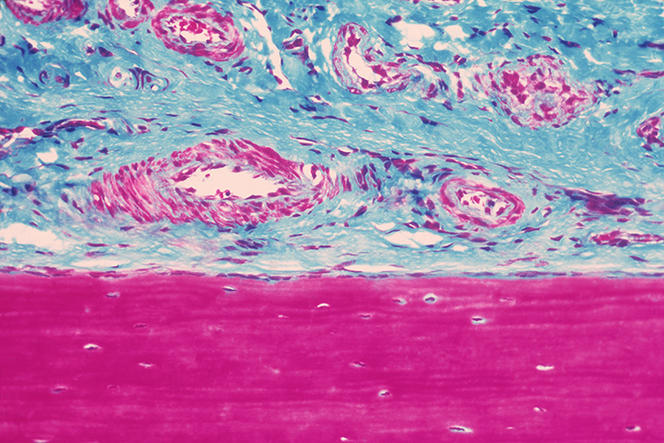
Pincez votre peau et observez la vitesse à laquelle elle reprend sa forme initiale. Si c’est instantané, il y a fort à parier que vous êtes jeune. Si cela prend plus de temps, vous avez probablement atteint un âge mûr… Normal : les fibres élastiques sont peu remplacées pendant la vie adulte et passé vingt ans, notre « capital élastique » tend à s’amenuiser. Ce que l’on sait moins, c’est que ces fibres élastiques sont présentes partout dans notre corps et s’avèrent indispensables à une grande variété de fonctions comme la respiration ou la nutrition. De plus, leur disparition constitue la cause ou le facteur aggravant d'une impressionnante diversité de pathologies qui vont de l’insuffisance cardiaque à la rupture d’anévrisme, en passant par la perte de voix ou la cécité. Pourtant, les chercheurs commencent tout juste à percer les mystères de ces fibres constituées de plus de trente protéines différentes (élastine, fibrillines, fibulines, lysyl oxydases, etc.). Leur but : élaborer des dispositifs pour protéger ces précieuses fibres élastiques, ou même les remplacer.
Un extrait d’aneth pour restaurer l’élasticité de la peau
Pascal Sommer, biologiste à l’Institut des sciences du mouvement1, compte parmi les quelques chercheurs français qui se sont penchés sur l’une des protéines clés des fibres élastiques : l’élastine.
Le rôle complexe de cette protéine, et son assemblage variable à partir d’une vingtaine d’acides aminés, ont été mis en évidence en 1998.
« Les souris chez qui le gène de l’élastine était inactivé mourraient à la naissance d’une cause inattendue : une hyper-prolifération cellulaire qui entraînait notamment des insuffisances cardiaques. L’environnement élastique des tissus modifie donc le fonctionnement cellulaire selon des mécanismes épigénétiquesFermerMécanismes moléculaires qui modifient l'expression des gènes en fonction de l’environnement, sans modifier le patrimoine génétique lui-même. L’environnement en question correspond à différents signaux, issus par exemple de l’alimentation, du tabagisme, du stress, etc., que reçoit la cellule en permanence. La modification de l’expression des gènes peut être transitoire, mais il existe des modifications épigénétiques pérennes, qui persistent lorsque le signal qui les a induites disparaît. », explique Pascal Sommer.
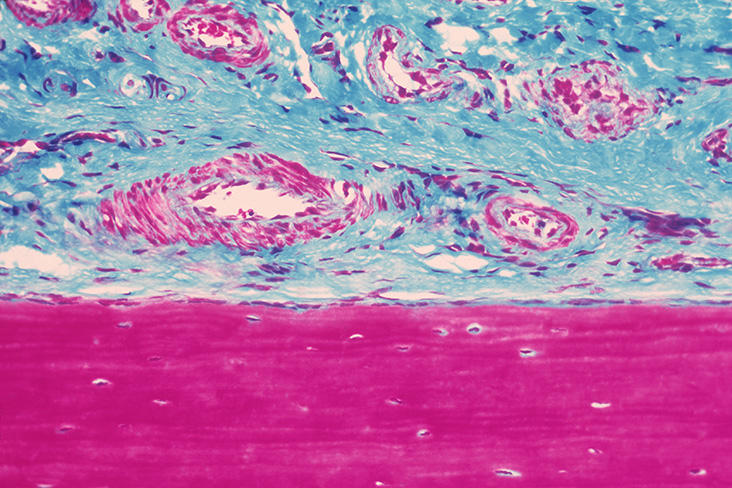
Plus tard, le chercheur et ses collaborateurs ont réalisé les premières études biomécaniques de l’élasticité de la peau chez l’humain en s’intéressant à des maladies rares des tissus élastiques comme la Cutis Laxa. Ce syndrome de « vieillissement prématuré » touche des enfants dont la peau présente à 18 ans l’élasticité d’individus de 80 ans. L’équipe planche également sur des approches thérapeutiques. Un premier brevet CNRS-BASF a d’ailleurs été déposé dès 2004 pour un extrait d’aneth susceptible de restaurer partiellement l’élasticité de la peau et d’autres tissus.
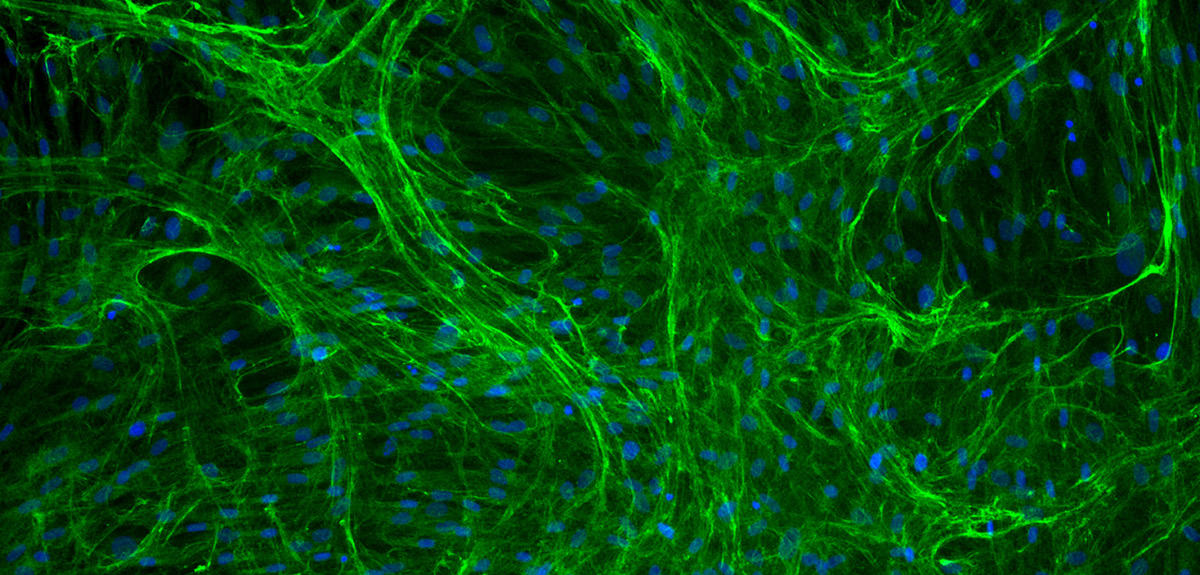
L’étude de l’élasticité a également conduit au développement de peaux artificielles. À travers le projet DHERMIC, Romain Debret, du laboratoire Biologie tissulaire et ingénierie thérapeutique2, a ainsi mis au point un analogue de l’élastine. La production de cet analogue repose sur des bactéries E. Coli génétiquement modifiées à l’intérieur desquelles un gène synthétique codant pour l’analogue a été inséré. Les bactéries cultivées en masse sont ensuite récoltées et broyées pour en extraire la protéine. Un vrai défi tant cette molécule complexe s’avère difficile à reproduire…
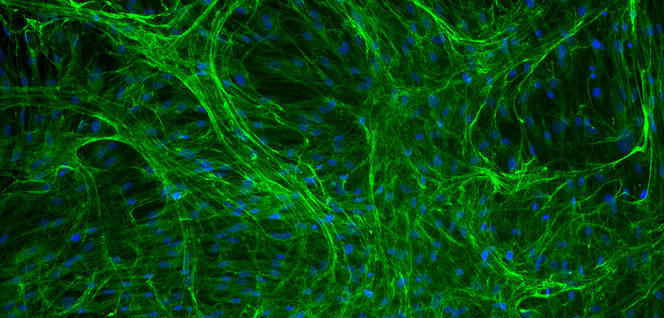
Le laboratoire Biologie tissulaire et ingénierie thérapeutique compte désormais parmi les quatre seuls laboratoires au monde à disposer de brevets sur ce sujet. Le groupe de Romain Debret a évalué l’injection de cette protéine élastique synthétique dans les artères des poissons-zèbres. « Nous avons montré qu’elle diffuse bien et se fixe dans les parois vasculaires comme escompté. Nous essayons maintenant de caractériser son effet sur le renforcement de l’élasticité de vaisseaux sanguins », détaille le biologiste.
« Coller » les bords d'une plaie en quelques secondes
Cet analogue d’élastine pourrait également favoriser l’élaboration de biomatériaux plus élastiques, comme des bio-encres élastiques pour l’impression 3D. Au sein du projet Nasaltis, on teste par exemple des polymères imitant les cartilages du nez, grâce à l’impression 3D. Objectif : améliorer l’élasticité des prothèses utilisées en rhinoplastie, les biomatériaux imprimables employés dans le domaine biomédical étant aujourd’hui trop rigides. Les maladies cardiovasculaires représentent également un enjeu primordial. Les vaisseaux sanguins possèdent en effet une capacité naturelle à se dilater et se contracter pour faciliter la circulation du sang sous l’effet des pulsations cardiaques. Or, cette élasticité manque encore aux prothèses vasculaires existantes, dont les matériaux relativement rigides limitent l’efficacité et la durabilité.
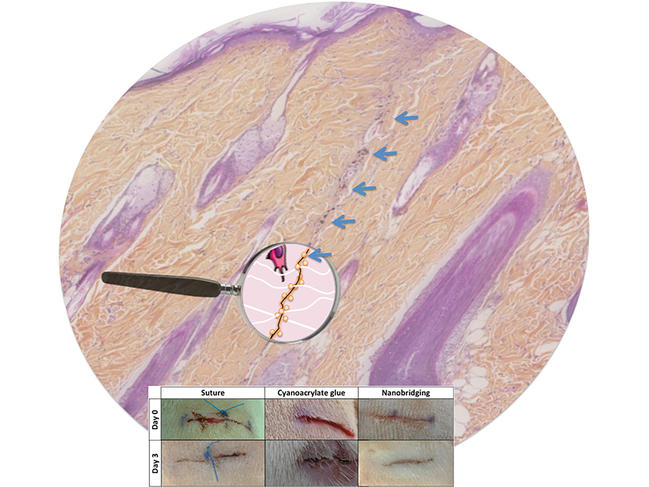
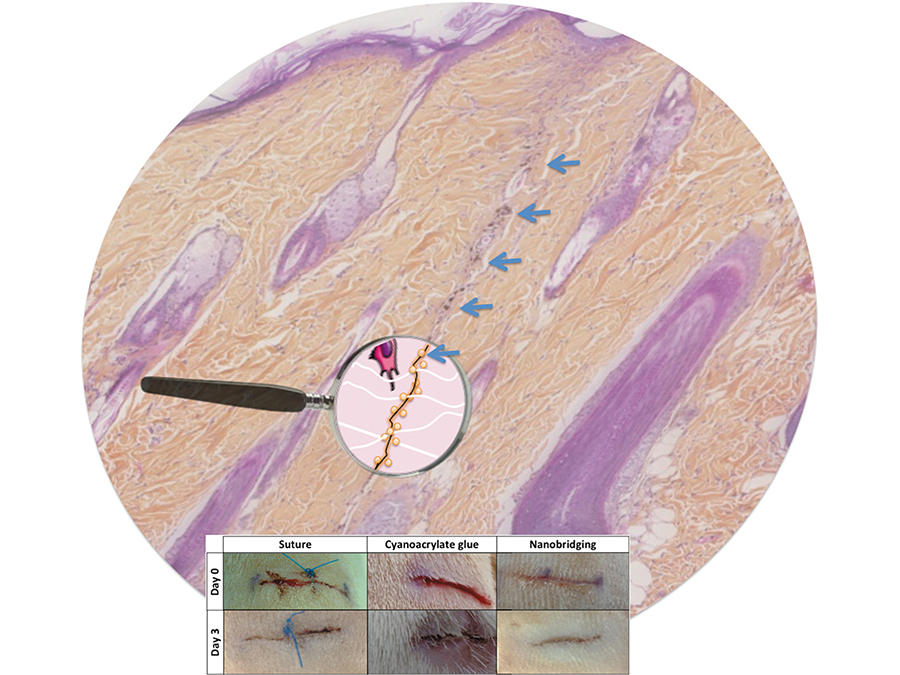
Didier Letourneur, directeur de recherche au Laboratoire de recherche vasculaire translationnelle3, s’intéresse de près à la question : « C’est une équation très compliquée car l’élasticité n’est qu’un des facteurs à prendre en compte pour élaborer des matériaux de prothèses vasculaires. Il faut aussi considérer leur biocompatibilité avec l’organisme, avec le sang, leur résistance mécanique, etc. D’où des temps de développement très longs », tempère le spécialiste de renommée mondiale. Son équipe a dévoilé en 2014, en collaboration avec celle de Ludwik Leibler du Laboratoire matière molle et chimie4, a mis au point une « biocolle » révolutionnaire. Pour la rendre adhérente aux tissus humains, y compris aux organes « mous » comme le foie ou le cœur, les chercheurs ont utilisé des nanoparticules dispersées dans une solution aqueuse.
Celles-ci se lient au réseau moléculaire du tissu (c’est l’adsorption) et, dans le même temps, le gel fixe les particules entre elles. Au final, cette biocolle permet de refermer en quelques secondes des plaies sur les organes et d’obtenir une cicatrisation de qualité.

Lucie Bailly et ses collaborateurs du laboratoire Sols, solides, structures, risques5 (3SR) se penchent pour leur part sur les mystères des plis vocaux – nom scientifique des cordes vocales – dont les propriétés élastiques sont à l'origine de nos capacités de phonation. Sous l’effet de l’écoulement d’air pulmonaire montant dans la trachée, les plis vocaux se déforment et produisent des vibrations périodiques qui modulent les fréquences de notre voix. « La façon dont se forment ces mouvements d’auto-oscillations et dont ils s’ajustent suivant le son produit reste mystérieuse car les propriétés microstructurales et biomécaniques du tissu vocal ne sont pas encore bien connues », indique Lucie Bailly. Un mystère que la chercheuse entend bien lever. En collaboration avec d'autres partenaires du site grenoblois6, le laboratoire 3SR a récemment obtenu des données prometteuses sur la composition microscopique du pli vocal et l'organisation 3D de ses réseaux de fibres grâce à des images haute résolution obtenues par microtomographie à rayons X synchrotron7.
À terme, ces travaux contribueront ainsi à mieux comprendre les pathologies vocales qui se caractérisent par un changement de microstructure du pli (polypes, nodules, cancers, etc.). Le laboratoire s’oriente également vers le développement de matériaux fibreux biocompatibles capables d'auto-oscillations, en recourant là encore à la protéine élastique synthétisée par le groupe de Romain Debret. « En cas d’intervention chirurgicale en profondeur, la restauration durable des capacités phonatoires des patients par des biomatériaux injectés ou des implants artificiels mimant les vibrations des plis vocaux reste un défi », estime la chercheuse.

Mais il y a plus surprenant : les propriétés élastiques s’avèrent parfois indispensables là où on ne les soupçonne pas… Par exemple dans nos os ! Ou plutôt dans la « peau » qui les recouvre. Appelé périoste, ce tissu vascularisé et souple contribue à régénérer l’os lors des fractures en facilitant le transfert de cellules réparatrices vers la zone en reconstruction.
Les biomécaniciens de l’équipe de Martine Pithioux, de l'Institut des sciences du mouvement8, tentent donc de reproduire cette membrane pour faciliter la guérison des fractures. L’équipe a développé une preuve de concept montrant les capacités importantes de régénération du périoste même dans des situations critiques, comme la régénération d’un gros volume osseux. Les travaux en cours, qui s’appuient sur les hydrogels d’élastine initialement développés pour les peaux artificielles, testent l’efficacité d’un tel substitut sur la fracture du fémur chez le rat, pour ensuite développer la même approche chez les humains. « À terme, cette méthode pourrait faciliter la régénération des grosses fractures, mais également la consolidation osseuse suite aux opérations d’allongement osseux, utilisées pour corriger par exemple les différences de longueur des jambes », espère Martine Pithioux.
Aphonie, fractures, maladies cardiovasculaires… Cette variété d’applications est d’autant plus prometteuse que l’ « humain élastique » est encore un domaine de recherche balbutiant. « Ce n’est que la récente apparition de concepts et d'outils qui a permis de s’en emparer », souligne Pascal Sommer. Les mécanismes d’assemblage des fibres élastiques à partir de l’élastine n’ont été pleinement caractérisés qu’en 1998. « Jusqu’ici, les propriétés d’élasticité étaient plutôt modélisées par rapport aux fibres de collagène, une famille de protéines qui confère leur rigidité aux tissus. Il a fallu du temps pour que les connaissances acquises par les biologistes sur les fibres élastiques elles-mêmes ne soient adoptées par d’autres domaines de recherche comme la biomécanique », raconte Martine Pithioux.
La mesure de l’élasticité, un atout pour le diagnostic
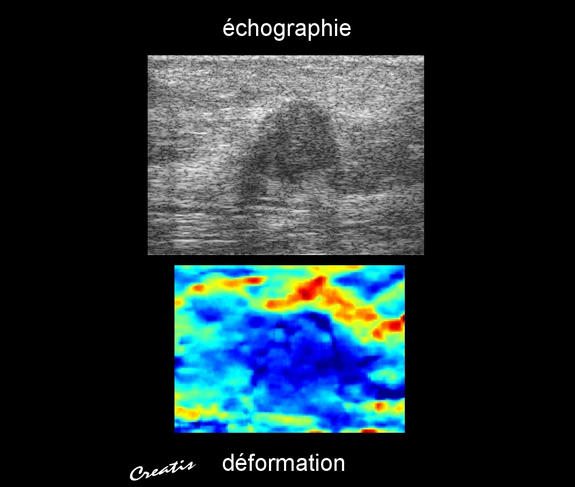
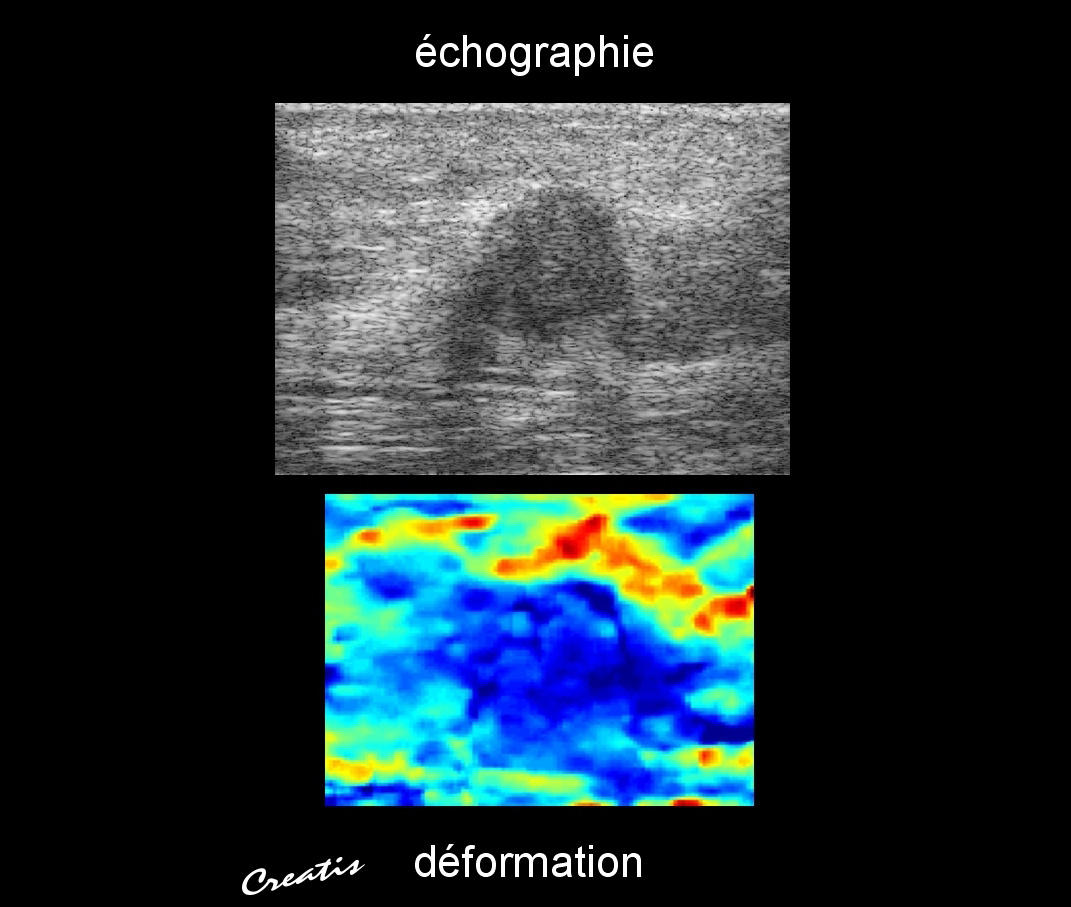
Mesurer l’élasticité des organes et des tissus est aussi longtemps resté problématique. La recherche française, en pointe sur la question des ultrasons, a contribué à résoudre ce problème en concevant au début des années 2000 de nouvelles techniques d’échographie ultrarapide.
« Les échographes traditionnels n’exploitaient que les ondes de compression, c’est à dire les ondes primaires, qui se diffusent par dilatations et compressions successives du milieu dans la direction de la propagation de l'onde, révèle Jean-François Aubry, directeur de recherche à l'Institut Langevin9. Or les propriétés élastiques des tissus sont reliées à un autre type d'ondes, les ondes de cisaillement, pour lesquelles les mouvements du milieu s’effectuent perpendiculairement au sens de propagation de l'onde. Tout comme les caméras ultrarapides permettent de révéler de stupéfiants détails invisibles à l’œil nu, les nouvelles techniques d'échographie ultrarapide permettent à présent de filmer acoustiquement la propagation des ondes de cisaillement et de remonter aux propriétés élastiques des tissus. »
La société française Supersonic Imagine, qui exploite en tout quatorze brevets du CNRS, est devenue leader mondial sur ces techniques.
Mais les derniers développements dépassent le domaine de la mesure. Ils permettent de modifier les propriétés élastiques des tissus par des techniques de chirurgie non intrusives qui « brûlent » au cœur des organes, et de manière ultra-localisée, des tissus malades grâce à des ultrasons de haute intensité. Entre autres applications, ces techniques pourraient permettre de guérir dans le cerveau des zones responsables des tremblements essentiels, des tremblements handicapants proches des tremblements parkinsoniens.
Comme dans tout champ de recherche neuf, de nombreux verrous restent à lever pour mieux comprendre l’élasticité et guérir les pathologies associées. Ses mécanismes sont liés à de subtils arrangements physico-chimiques au niveau de molécules ou entre molécules et peuvent être étudiés à différentes échelles. À ce titre, les modèles mathématiques de l’élasticité, élaborés par les physiciens et mécaniciens, demeurent difficiles à appliquer au vivant. « La question se pose de savoir quelle échelle est la plus pertinente pour étudier ces propriétés – moléculaire ? cellulaire ? macroscopique ? – de manière à savoir quels modèles mathématiques mobiliser », détaille Yves Rémond, directeur adjoint scientifique de l’INSIS (Institut des sciences de l’ingénierie et des systèmes), du CNRS. Biologistes, biomécaniciens, physiciens doivent donc dialoguer pour progresser. Une approche interdisciplinaire dont ont pris acte Pascal Sommer et Yves Rémond : lors d’un récent colloque sur l’humain élastique au siège du CNRS, les deux scientifiques ont annoncé la création prochaine d’une Société internationale de bio-élasticité. La discipline n’a pas fini de faire parler d’elle !
À lire aussi :
Le Point de vue de Pascal Sommer « Réparer les corps élastiques »
- 1. Unité CNRS/Université Aix-Marseille.
- 2. Unité CNRS/Université Lyon 1.
- 3. Unité Inserm/Université Paris Diderot.
- 4. Unité CNRS/ESPCI ParisTech.
- 5. Unité CNRS/Université Grenoble Alpes UGA/Grenoble-INP.
- 6. GIPSA-lab, LADAF, NOVITOM, ESRF-ID19.
- 7. Cette technique d’imagerie de pointe est utilisée en sciences des matériaux pour scanner la structure interne d'un échantillon.
- 8. Unité CNRS/Université Aix-Marseille.
- 9. Unité CNRS/ESPCI ParisTech/UPMC/Univ. Paris Diderot/Inserm.


























Commentaires
Connectez-vous, rejoignez la communauté
du journal CNRS